Соавтор(ы): Bess Ruff, MA. Бесс Руфф — аспирантка Университета штата Флорида, работает над получением степени PhD по географии. Получила степень магистра экологии и менеджмента в Калифорнийском университете в Санта-Барбаре в 2016 году. Проводила исследования для проектов по морскому пространственному планированию в Карибском море и обеспечивала научную поддержку в качестве дипломированного участника Группы устойчивого рыболовства.
Количество просмотров этой статьи: 247 619.
В этой статье:
Если таблица Менделеева кажется вам сложной для понимания, вы не одиноки! Хотя бывает непросто понять ее принципы, умение работать с ней поможет при изучении естественных наук. Для начала изучите структуру таблицы и то, какую информацию можно узнать из нее о каждом химическом элементе. Затем можно приступить к изучению свойств каждого элемента. Наконец, с помощью таблицы Менделеева можно определить число нейтронов в атоме того или иного химического элемента.
Часть 1 из 3:
TOP 6 ХИМИЧЕСКИХ СОЕДИНЕНИЙ В МАЙНКРАФТ ПЕ 1.2.20.1
Структура таблицы

- Атомная масса увеличивается слева направо и сверху вниз, поскольку в атомах элементов с бо́льшим номером содержится больше протонов и нейтронов. Каждый последующий элемент содержит больше протонов, чем предыдущий, поэтому возрастает и его атомная масса.
- В атомной массе не учитываются электроны, поскольку они весят намного меньше, чем протоны и нейтроны. [1] X Источник информации

- Например, первая строка таблицы содержит водород, который имеет атомный номер 1, и гелий с атомным номером 2. Однако они расположены на противоположных краях, так как принадлежат к разным группам.

- Водород можно отнести как к группе щелочных металлов, так и к группе галогенов. В некоторых таблицах его указывают в обеих группах.
- В большинстве случаев группы пронумерованы от 1 до 18, и номера ставятся вверху или внизу таблицы. Номера могут быть указаны римскими (например, IA) или арабскими (например,1A или 1) цифрами.
- При движении вдоль колонки сверху вниз говорят, что вы «просматриваете группу».

- Например, первые 3 строки имеют пустые ячейки, поскольку переходные металлы встречаются лишь с атомного номера 21.
- Элементы с атомными номерами с 57 по 71 относятся к редкоземельным элементам, и обычно их выносят в отдельную подгруппу в нижнем правом углу таблицы.

- Например, атомы элементов первого периода имеют одну орбиталь, а атомы элементов седьмого периода — 7 орбиталей.
- Как правило, периоды обозначаются цифрами от 1 до 7 слева таблицы.
- При движении вдоль строки слева направо говорят, что вы «просматриваете период».

- Помните, что по свойствам водород можно отнести как к щелочным металлам, так и к галогенам, поэтому он может иметь разный цвет и располагаться в двух ячейках.
- Металлические элементы блестят, являются твердыми при комнатной температуре (за исключением ртути), хорошо проводят тепло и электрический заряд и достаточно пластичны.
- Неметаллы не имеют выраженного блеска, плохо проводят тепло и электрический заряд, обладают низкой пластичностью. Как правило, при комнатной температуре неметаллические элементы представляют собой газ, но при определенных температурах и давлениях они могут принимать жидкое или твердое состояние.
- Металлоиды совмещают в себе свойства металлов и неметаллов. [8] X Источник информации
Часть 2 из 3:
Обозначения элементов

- Обычно символы элементов являются сокращением их латинского названия, хотя для некоторых, особенно недавно открытых элементов, они получены из общепринятого названия. К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.

- Иногда в таблице не указываются названия элементов и приводятся лишь их химические символы.

- Атомный номер всегда является целым числом.

- По атомному номеру элемента можно также определить количество электронов и нейтронов в атоме.

- Ионы имеют электрический заряд. Если в ионе больше протонов, то он обладает положительным зарядом, и в этом случае после символа элемента ставится знак «плюс». Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус».
- Знаки «плюс» и «минус» не ставятся, если атом не является ионом.
Часть 3 из 3:
Вычисление количества нейтронов по атомной массе

- Поскольку атомная масса представляет собой среднюю величину, для большинства элементов она записывается в виде десятичной дроби.
- Хотя может показаться, что атомная масса всегда возрастает при движении слева направо и сверху вниз, это справедливо не во всех случаях.
- Например, атомная масса углерода составляет 12,011, после округления получаем 12. Для железа, атомная масса которого равна 55,847, получаем 56.

- Используйте следующую формулу: Число нейтронов = Массовое число – Число протонов.
- Например, массовое число углерода равно 12, и атом углерода имеет 6 протонов. Поскольку 12 – 6 = 6, атом углерода содержит 6 нейтронов.
- Массовое число железа составляет 56, и его атом содержит 26 протонов. Так как 56 – 26 = 30, в атоме железа содержится 30 нейтронов.
- Изотопы элементов имеют разное количество нейтронов, благодаря чему меняется их атомная масса.
- Многим сложно освоить таблицу Менделеева. Не расстраивайтесь, если столкнетесь с определенными трудностями!
- Хотя цвета могут меняться, они передают одну и ту же информацию.
- Встречаются упрощенные таблицы. Например, в таблице могут содержаться лишь символы элементов и их атомные номера. Выберите такую таблицу, которая подходит для ваших целей.
Дополнительные статьи

найти число протонов, нейтронов и электронов

сделать слоновью зубную пасту

написать электронную конфигурацию атома любого элемента

рассчитать концентрацию раствора
сделать кристаллы соли

определить валентные электроны

написать ионное уравнение

рассчитать нормальность раствора

разбавить раствор

посчитать pH

найти энтальпию реакции

посчитать молярную массу

найти электроны

балансировать химические уравнения
- ↑http://www.csun.edu/~psk17793/G%20Chemistry/reading_the_periodic_table.htm
- ↑http://www.csun.edu/~psk17793/G%20Chemistry/reading_the_periodic_table.htm
- ↑http://www.csun.edu/~psk17793/G%20Chemistry/reading_the_periodic_table.htm
- ↑http://www.chem4kids.com/files/elem_pertable.html
- ↑http://www.csun.edu/~psk17793/G%20Chemistry/reading_the_periodic_table.htm
- ↑http://www.chem4kids.com/files/elem_pertable.html
- ↑http://www.csun.edu/~psk17793/G%20Chemistry/reading_the_periodic_table.htm
- ↑http://www.csun.edu/~psk17793/G%20Chemistry/reading_the_periodic_table.htm
- ↑http://www.chem4kids.com/files/elem_pertable.html
- ↑http://www.chem4kids.com/files/elem_pertable.html
- ↑http://www.chem4kids.com/files/elem_pertable.html
- ↑http://education.jlab.org/qa/pen_number.html
- ↑http://education.jlab.org/qa/pen_number.html
- ↑https://education.jlab.org/qa/pen_number.html
- ↑https://education.jlab.org/qa/pen_number.html
- ↑https://education.jlab.org/qa/pen_number.html
Об этой статье
Соавтор(ы): Bess Ruff, MA. Бесс Руфф — аспирантка Университета штата Флорида, работает над получением степени PhD по географии. Получила степень магистра экологии и менеджмента в Калифорнийском университете в Санта-Барбаре в 2016 году. Проводила исследования для проектов по морскому пространственному планированию в Карибском море и обеспечивала научную поддержку в качестве дипломированного участника Группы устойчивого рыболовства. Количество просмотров этой статьи: 247 619.
Источник: ru.wikihow.com
Таблица Менделеева: что это такое и как ей пользоваться
Как пользоваться таблицей Менделеева? Для непосвященного человека читать таблицу Менделеева – всё равно, что для гнома смотреть на древние руны эльфов. А таблица Менделеева может рассказать о мире очень многое.
Помимо того, что сослужит вам службу на экзамене, она еще и просто незаменима при решении огромного количества химических и физических задач. Но как ее читать? К счастью, сегодня этому искусству может научиться каждый. В этой статье расскажем, как понять таблицу Менделеева.
Периодическая система химических элементов (таблица Менделеева) – это классификация химических элементов, которая устанавливает зависимость различных свойств элементов от заряда атомного ядра.
История создания Таблицы
Дмитрий Иванович Менделеев был не простым химиком, если кто-то так думает. Это был химик, физик, геолог, метролог, эколог, экономист, нефтяник, воздухоплаватель, приборостроитель и педагог. За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов.
Не знаем, как Менделеев относился к водке, но точно известно, что его диссертация на тему «Рассуждение о соединении спирта с водой» не имела к водке никакого отношения и рассматривала концентрации спирта от 70 градусов. При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.

Существует легенда, согласно которой периодическая система приснилась ученому, после чего ему осталось лишь доработать явившуюся идею. Но, если бы все было так просто.. Данная версия о создании таблицы Менделеева, по-видимому, не более чем легенда. На вопрос о том, как была открыта таблица, сам Дмитрий Иванович отвечал: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово»
В середине девятнадцатого века попытки упорядочить известные химические элементы (известно было 63 элемента) параллельно предпринимались несколькими учеными. Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств.
Химик и музыкант Джон Александр Ньюлендс предложил свой вариант периодической таблицы в 1866 году. Интересен тот факт, что в расположении элементов ученый пытался обнаружить некую мистическую музыкальную гармонию. В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.

В 1869 году была опубликована первая схема таблицы, а день 1 марта 1869 года считается днем открытия периодического закона. Суть открытия Менделеева состояла в том, что свойства элементов с ростом атомной массы изменяются не монотонно, а периодически.
Первый вариант таблицы содержал всего 63 элемента, но Менделеев предпринял ряд очень нестандартных решений. Так, он догадался оставлять в таблице место для еще неоткрытых элементов, а также изменил атомные массы некоторых элементов. Принципиальная правильность закона, выведенного Менделеевым, подтвердилась очень скоро, после открытия галлия, скандия и германия, существование которых было предсказано ученым.
Современный вид таблицы Менделеева
Ниже приведем саму таблицу
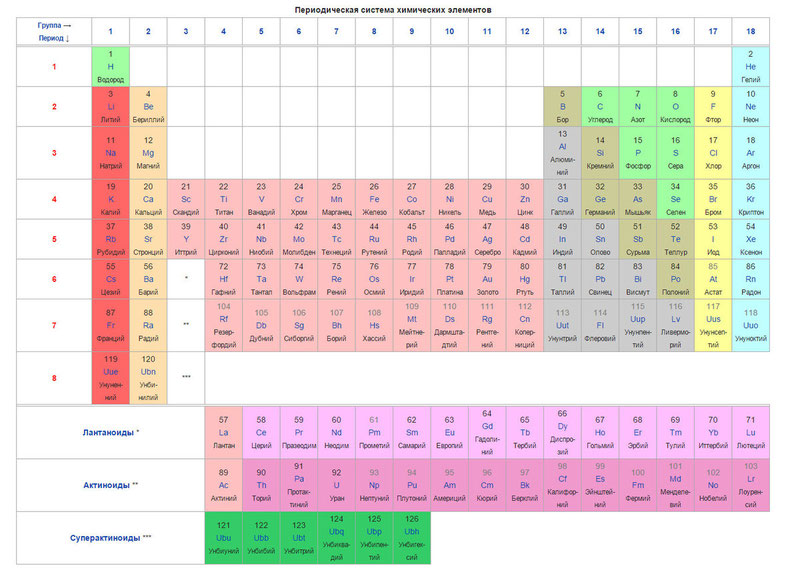
Сегодня для упорядочения элементов вместо атомного веса (атомной массы) используется понятие атомного числа (числа протонов в ядре). В таблице содержится 120 элементов, которые расположены слева направо в порядке возрастания атомного числа (числа протонов)
Столбцы таблицы представляют собой так называемые группы, а строки – периоды. В таблице 18 групп и 8 периодов.
- Металлические свойства элементов при движении вдоль периода слева направо уменьшаются, а в обратном направлении – увеличиваются.
- Размеры атомов при перемещении слева направо вдоль периодов уменьшаются.
- При движении сверху вниз по группе увеличиваются восстановительные металлические свойства.
- Окислительные и неметаллические свойства при движении вдоль периода слева направо увеличиваются.
Что мы узнаем об элементе по таблице? Для примера, возьмем третий элемент в таблице – литий, и рассмотрим его подробно.
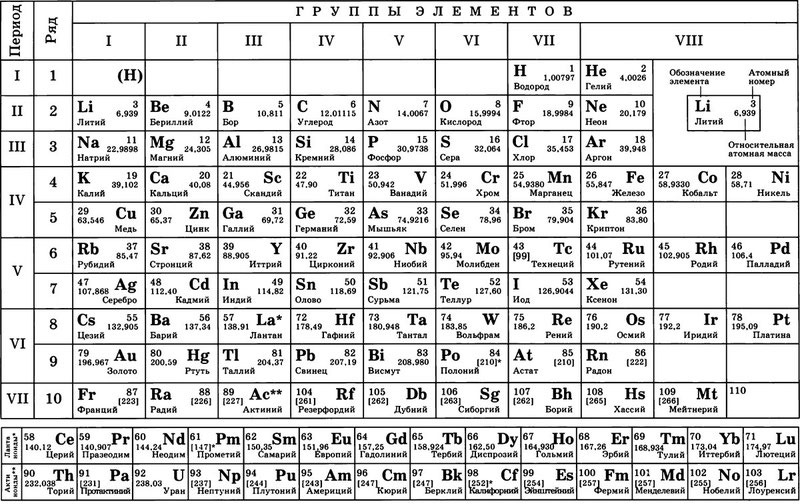
Первым делом мы видим сам символ элемента и его название под ним. В верхнем левом углу находится атомный номер элемента, в порядке которого элемент расположен в таблице. Атомный номер, как уже было сказано, равен числу протонов в ядре. Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
Атомная масса указана под атомным числом (в данном варианте таблицы). Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число. Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
Вот и закончился наш курс «Таблица Менделеева для чайников». В завершение, предлагаем вам посмотреть тематическое видео, и надеемся, что вопрос о том, как пользоваться периодической таблицей Менделеева, стал вам более понятен. Напоминаем, что изучать новый предмет всегда эффективнее не одному, а при помощи опытного наставника. Именно поэтому, никогда не стоит забывать о студенческом сервисе, который с радостью поделится с вами своими знаниями и опытом.
Мы поможем сдать на отлично и без пересдач
- Контрольная работа от 1 дня / от 120 р. Узнать стоимость
- Дипломная работа от 7 дней / от 9540 р. Узнать стоимость
- Курсовая работа 5 дней / от 2160 р. Узнать стоимость
- Реферат от 1 дня / от 840 р. Узнать стоимость
Иван Колобков, известный также как Джони. Маркетолог, аналитик и копирайтер компании Zaochnik. Подающий надежды молодой писатель. Питает любовь к физике, раритетным вещам и творчеству Ч. Буковски.
Источник: zaochnik.ru
Таблица Менделеева online
Таблица Менделеева, (или периодическая система химических элементов) — это таблица, которая квалифицирует химические элементы по различным свойствам, зависящим от заряда атомного ядра. Эта система выражает, в виде таблицы, периодический закон химических элементов, который в 1869 году открыл Русский ученый химик Д.И. Менделеев.
Самый первый вариант таблицы, был разработан Менделеевым в 1869-1871 годах, он определял зависимость свойств химических элементов, от атомной массы (в то время это называлось атомным весом). Было предложено несколько сотен различных вариантов изображения свойств химических элементов, от аналитических кривых графиков, и до различных геометрических фигур. Но ученые, в конце концов, сошлись во мнении, что самым удобным вариантом будет изображение в виде двухмерной таблицы, в которой каждый столбик будет указывать на физико-химические свойства того или иного элемента, а периоды элементов приближенных друг к другу, будут определять строки таблицы.
Поделиться ссылкой:
Понравился сайт? Разместите у себя его баннер!
Сайт сделан admhome в 2006 году и переработан в 2018 году
Источник: table-mendeleev.ru