
Существует масса рекомендаций по лечению и профилактике гриппа и ОРВИ, однако большинство из них вызывает споры среди медиков. С помощью специалистов и научных данных Роскачество разобралось, имеет ли смысл есть чеснок и мед, делать ингаляции, а также чем опасны средства для иммунитета.
Ни для кого не секрет, что основной источник инфекции – зараженные люди: частицы их слюны и мокроты, которые разлетаются при разговоре и кашле, и даже предметы, к которым они прикасались немытыми руками.

главный врач детского отделения клиники доказательной медицины «Рассвет»
– В первую очередь рекомендует избегать мест скопления людей и регулярно мыть руки с мылом (или специальными средствами с этиловым спиртом в составе). А немытыми руками не трогать глаза, рот, нос и вообще не прикасаться к лицу. Вирус может выживать во внешней среде до двух часов.
Skyrim Как сделать зелье исцеления болезней
Самые частые рекомендации при гриппе – носить маску, есть лук, чеснок, употреблять витамин С и принимать средства, повышающие иммунитет. Однако на сегодня эти способы профилактики не вызывают доверия у врачей, опирающихся на принципы доказательной медицины.
О том, какие вакцины против гриппа разрабатывают ученые, читайте ЗДЕСЬ
Помогает ли маска?
Наталья Васильева поясняет, что маска не выполняет барьерной функции. Как правило, в аптеках продаются самые простые и недорогие маски, которые пропускают через себя микроскопические частицы вируса. Кроме того, они неплотно прилегают к лицу – вирус запросто «протискивается» в эти промежутки.
Педиатр отмечает, что этот способ защиты предназначен для того, чтобы сам больной не заражал окружающих так активно. Правда, маску надо менять каждые два часа.
Как правильно болеть?
Прежде всего, если вы заболели, постарайтесь не заразить окружающих вас людей. Носите маску, сморкайтесь в одноразовые бумажные платочки (и сразу выкидывайте их), а чихать и кашлять лучше в изгиб локтя – тогда вирус останется хотя бы не на пальцах, которыми вы дотрагиваетесь до предметов общего пользования.
– При болезни обязательны сон, отдых, гигиена, обильное питье (кстати, потеть необязательно – при этом выходит мало вредных веществ, а если пить мало, то можно дойти до обезвоживания), при плохом самочувствии можно выпить ибупрофен или парацетамол, – говорит Наталья Васильева.

Екатерина Степанова
врач-инфекционист, заведующая отделением иммунопрофилактики Университетской клиники профилактики и лечения инфекционных заболеваний H-Clinic
Что касается запрета на купание, при вирусной инфекции нежелательны только горячая ванна и душ – они будут способствовать распространению вируса по организму. Но это не значит, что нужно полностью отказываться от мытья.
SKYRIM — Как вылечится от вампиризма
Кстати, вопреки устоявшемуся правилу, мороженое при больном горле и кашле тоже не противопоказано. Оно довольно питательное, а прохлада облегчит боль (небольшая и неспешно съеденная порция не усилит воспаление).
Если у вас действительно грипп (многие часто путают его с простудой и огорчаются, что прививка не помогла), то необходимо применять противовирусные препараты: осельтамивир («Тамифлю», «Номидес») и занамивир («Реленза»).И чем быстрее начать их прием, тем лучше. Раньше в арсенале был еще «Римантадин», но он сошел с дистанции после того, как большинство штаммов выработали к нему устойчивость.
Наталья Васильева добавляет, что ни в коем случае не надо принимать антибиотики – они показаны при бактериальных, а не вирусных инфекциях, потому что при использовании антибиотиков формируется устойчивость находящихся в организме бактерий к антибиотикам, из-за чего бактериальные инфекции трудно лечить.
Горчичники и ингаляции (влажный воздух действительно полезен для слизистой, но он необязательно должен быть горячим) тоже остаются за бортом доказанных и проверенных способов. Увы, к ним в компанию отправляются и средства для иммунитета.
Почему не надо принимать иммуномодуляторы?
– Иммунитет невозможно укрепить, это не покосившийся забор, – говорит доктор Васильева. – Доказательная медицина не рассматривает всерьез такие методы.
А Екатерина Степанова поясняет, что иммунная система очень сложна и пока недостаточно изучена, чтобы вмешиваться и пытаться заставить ее работать лучше.
– Я категорически против таких средств. Может быть, какие-то из них и правда работают, но мы точно не знаем, какой ценой дается этот эффект. Иммунные клетки вырабатываются в костном мозге, далее они «дозревают» в вилочковой железе и лимфоузлах – это занимает длительное время.
Как беременная женщина не может родить здорового трехкилограммового малыша на третьем месяце, так и иммунитет не может начать вырабатывать иммунные клетки с утроенной скоростью. Поэтому часто он вынужден брать их из собственных резервов, но эти резервы тоже не просто так создавались. Таким образом, природный баланс нарушается, и неясно, к чему это впоследствии приведет – вероятно, что за кратковременное повышение (некоторые иммуностимуляторы действительно повышают иммунитет) потом придется расплачиваться сбоями в иммунитете, – подытоживает инфекционист.

Иван Коновалов
доцент кафедры инфекционных болезней у детей РНИМУ им. Н. И. Пирогова, кандидат медицинских наук
На данный момент эта группа препаратов не имеет единой классификации, системы, что осложняет их использование на практике. Несмотря на довольно большие и, возможно, перспективные разработки, у многих из этих веществ отсутствует необходимый объем доказательной базы. Да, есть вещества, нацеленные на определенные звенья иммунной системы, но она на то и система, в ней все взаимосвязано, и одна перемена влечет за собой другие. Все очень индивидуально: у одного пациента она нуждается в стимуляции, а у другого, наоборот, в подавлении. И если мы говорим о гриппе, то у здорового человека он обычно вызывает гиперстимуляцию иммунитета, что может приводить к тяжелым осложнениям (таким как поражение сосудистой стенки с возможными кровоизлияниями в различные органы и системы), а также быстрому истощению, на фоне которого может присоединиться бактериальная инфекция.
Имеет ли смысл есть чеснок, мед, принимать витамин С?
Врачи, подбирающие лечение и профилактику только на основе доказанных и безопасных методов, такие средства всерьез не рассматривают – слишком слабая доказательная база.
Наталья Васильева считает, что народные средства не оказывают никакого эффекта – разве что вкусный чай с лимоном и имбирем улучшает настроение. Не будем забывать и про эффект плацебо.
– Возможно, что-то из перечисленного и помогает, по крайней мере практически никогда не вредит (разве что людям с больным желудком не надо налегать на чеснок), но мы не можем на полном серьезе давать такие рекомендации для профилактики и лечения гриппа и ОРЗ, – рассказывает Екатерина Степанова.
Согласно обзорам Кокрановского сообщества (международная некоммерческая организация, которая прославилась независимыми анализами всех имеющихся в мире исследований по различным темам и беспристрастной их оценкой), чеснок все-таки показал некоторый профилактический эффект от ОРВИ, однако независимые эксперты сомневаются в качестве исследований и отмечают, что для вынесения окончательного вердикта нужно больше наблюдений.
Примерно так же обстоят дела и с эхинацеей.
А вот мед, согласно тем же обзорам, может помочь при кашле.
Лечебные свойства витамина С тоже преувеличены. Если он и может оказывать какой-то эффект, то только после использования мегадоз, но переизбыток практически любого соединения может быть вреден для здоровья.
Подытоживая, все врачи сходятся во мнении, что прививка – лучшая профилактика гриппа (делать ее лучше в первой половине дня и в хорошем настроении – это может влиять на эффективность), а здоровый образ жизни – отличная профилактика прочих ОРЗ. Сон, движение, полноценное питание, питье и отсутствие стресса – лучшей поддержки для нашего иммунитета еще не открыли.
Следите за новостями, подписывайтесь на рассылку.
При цитировании данного материала активная ссылка на источник обязательна.
Источник: rskrf.ru
Клещевой боррелиоз: болезнь на всю жизнь?
Клещевой энцефалит — опасное вирусное заболевание, поражающее центральную нервную систему, — вряд ли нуждается в представлении, особенно в связи с недавним всплеском заболеваемости. А вот к проблеме другой, но уже бактериальной, инфекции, также переносимой клещами, внимание врачей и ученых России было привлечено сравнительно недавно
В России боррелиоз (или болезнь Лайма, как ее называют в США) был впервые серологически (т. е. на основе наличия специфических антител) выявлен сотрудниками научно-исследовательского института эпидемиологии и микробиологии им. Н. Ф. Гамалеи РАМН под руководством Э. И. Коренберга в 1985 г. Но только в 1991 г. иксодовые клещевые боррелиозы (ИКБ) были включены в официальный государственный перечень заболеваний, регистрируемых на территории России.
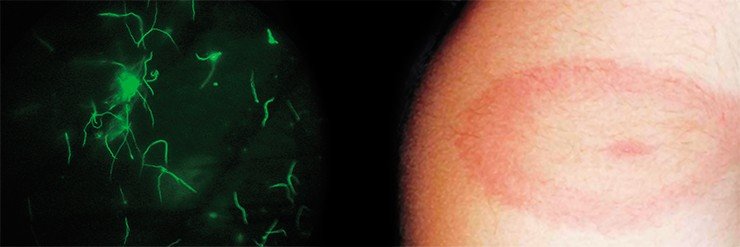
Наиболее распространенным этот недуг признан в США: ежегодно там заболевает более 16 тыс. человек. Рост заболеваемости боррелиозом в настоящее время наблюдается и во многих странах Европы.
Возбудитель — спирохета
Уже из самого названия видно, что переносчиками этой болезни, также как и клещевого энцефалита, являются клещи. В США болезнь Лайма переносят клещи Ixodes scapularis (в 1982 г. американский исследователь В. Бургдорфер именно от этих клещей впервые изолировал самих инфекционных агентов — боррелий); в Европе эту функцию выполняют клещи Ixodes ricinus, а у нас — печально известные таежные клещи Ixodes persulcatus.
Возбудитель боррелиоза — спирохета комплекса под пышным латинским названием Borrelia burgdorferi sensu lato (s. l.) — состоит в близком родстве с трепонемой — возбудителем всем известного сифилиса — и лептоспирой — возбудителем лептоспироза, серьезного заболевания, которому подвержены многие виды животных, и человек в том числе. Все перечисленные спирохеты имеют сходный внешний вид и по форме напоминают извитую спираль.
К сегодняшнему дню на основании генетических и фенотипических различий выделено 12 видов боррелий, но опасными для человека до недавнего времени считалось только три вида: B. burgdorferi sensu stricto (s.s.), B. afzelii и B. garinii. Однако в последнее время появились сообщения, что от больных ИКБ был выделен еще один вид — B. spielmanii, что говорит о возможной патогенности и этого вида.
Боррелии способны не только передвигаться под кожей, но и проникать в кровеносные сосуды, перемещаясь с током крови во внутренние органы. Не является для них преградой и гематоэнцефалический барьер, защищающий кровеносные сосуды мозга
Боррелии распространены по регионам мира неравномерно. В России основное эпидемиологическое значение имеют два вида — B. afzelii и B. garinii, которые обнаружены в обширной лесной зоне от Прибалтики до Южного Сахалина.
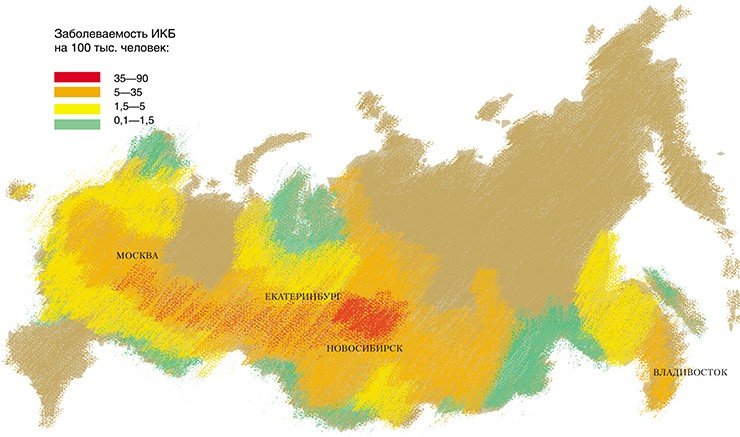
В Институте химической биологии и фундаментальной медицины изучение боррелий было начато в 2000 г. Исследования, проведенные совместно с Институтом систематики и экологии животных СО РАН, направленные на выявление видового разнообразия боррелий, циркулирующих в природных очагах ИКБ Новосибирской области, позволили установить ряд фактов. Помимо широко распространенных B. afzelii и B. garinii были обнаружены редко встречающиеся генетические варианты этих видов.
Согласно данным световой микроскопии, зараженность таежных клещей боррелиями на территории Новосибирской области составляет 12—25 %. При микроскопическом исследовании фиксированных и витальных препаратов боррелии были выявлены как у взрослых клещей, собранных с растений, так и у частично или полностью напитавшихся личинок и нимф.
Поскольку эти спирохеты были обнаружены на всех стадиях развития клещей — от личинок до взрослых особей (имаго), все они могут служить источниками заражения. Цикл переноса возбудителя начинается с процесса питания неинфекционного клеща на инфицированном животном. Клещи, зараженные боррелиями, при следующем кормлении способны передавать эти микроорганизмы здоровым животным, а также продолжать воспринимать дополнительную «порцию» спирохет от инфицированных млекопитающих. На ранних этапах развития клеща в данный процесс вовлечены мелкие млекопитающие; взрослые клещи начинают питаться на крупных млекопитающих, и кроме того могут «покушаться» на человека, заражая его.
Проникнув в тело млекопитающего вместе со слюною клеща, спирохеты начинают усиленно размножаться в кожных покровах на месте укуса. Они способны не только передвигаться под кожей, но и проникать в кровеносные сосуды, перемещаясь с током крови во внутренние органы. Не является для них преградой и гематоэнцефалический барьер: размножаясь в спинномозговой жидкости, боррелии становятся причиной тяжелых нейроинфекций.
Первая стадия — обратимая
Иксодовый клещевой боррелиоз — полисистемное заболевание, при котором возможны поражения кожи, опорно-двигательного аппарата, нервной и сердечно-сосудистой систем. Характер клинических проявлений заболевания зависит от его стадии. Условно выделяют три стадии боррелиозной инфекции, хотя четко различить их не всегда удается. Заболевание, как правило, развивается последовательно, переходя из одной стадии в другую.
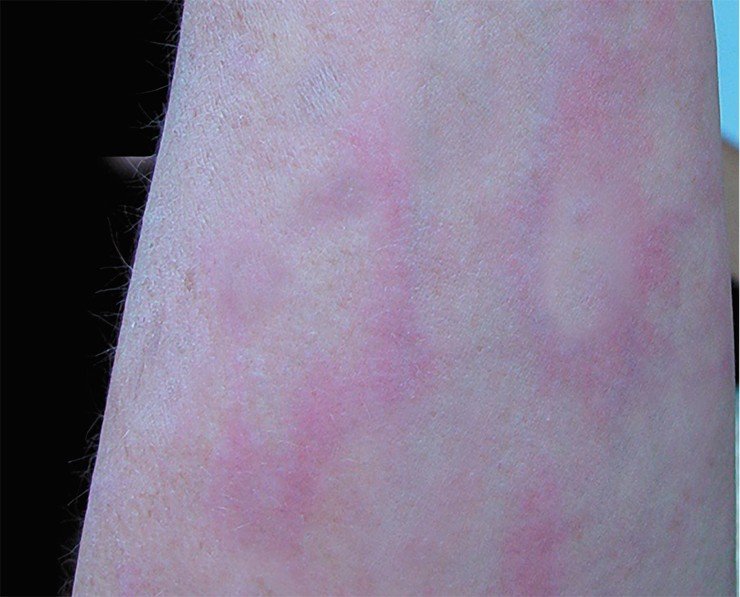
Первая стадия длится от 3 до 30 дней. За этот отрезок времени на коже (в области укуса клеща) вследствие воспалительной реакции может появиться красное кольцо, которое так и называется: кольцевая мигрирующая эритема. Начинается она с небольшого пятна в месте присасывания клеща, которое постепенно мигрирует к периферии. В типичных случаях центр пятна светлеет, а периферические участки образуют яркий красный валик в виде кольца неправильной формы диаметром до 15 см.
Исследования кожных проб, взятых из разных участков эритемы, свидетельствуют о том, что в центре эритемного кольца боррелии практически отсутствуют, но, как правило, они всегда обнаруживаются на периферии. По сравнению с другими воспалительными изменениями эритема может сохраняться на коже в течение достаточно длительного промежутка времени.

Примерно у четверти больных кожные проявления заболевания сопровождаются такими симптомами, как: озноб, сонливость, мышечная слабость, боли в суставах и увеличение лимфатических узлов. Это сигнализирует о том, что боррелии распространяются по организму. Однако у большинства больных с эритемой ранние стадии болезни не сопровождаются симптомами интоксикации. К тому же, существует и так называемая безэритемная форма, которая, как правило, начинается остро и осложнена высокой температурой, болью в суставах и головной болью.

Также нужно отметить, что отсутствие симптомов болезни в первое время после укуса клеща не исключает развития болезни в будущем. При проведении своевременного лечения на первой стадии заболевания возможно полное выздоровление.
Лечение поздней стадии боррелиоза, развивающейся через полгода — год после заражения, требует длительного курса антибактериальной терапии. И борьба с хронической болезнью не всегда бывает успешной
Вторая стадия боррелиоза развивается в среднем через 1—3 месяца после инфицирования. К этому времени боррелии с током крови и лимфы попадают в различные органы и ткани, такие как: мышцы, суставы, миокард, спинной и головной мозг, а также селезенка, печень, сетчатка глаза, — и поражают их. Вот почему данную стадию характеризует столь значительное разнообразие клинических проявлений заболевания: неврологических, сердечных, кожных и т. д.
Признаки поражения нервной системы проявляются в виде менингита, моно- и полиневритов, очень часто — неврита лицевого нерва и др. Многие из этих симптомов могут наблюдаться одновременно. Наиболее частым неврологическим проявлением можно назвать менингополирадикулоневрит (синдром Баннаварта), характеризующийся парезом лицевого нерва. Кроме того, на этой стадии у некоторых больных могут появиться вторичные эритемы.
Наконец, третья стадия боррелиоза развивается через полгода — год после проникновения инфекции в организм. Чаще всего встречаются поражения суставов (хронический артрит), кожи (атрофический акродерматит) и хронические поражения нервной системы (хронический нейроборрелиоз). Лечение поздней стадии боррелиоза требует длительного курса антибактериальной терапии, однако впоследствии у некоторых больных с артритами признаки хронической инфекции наблюдаются в течение месяцев и даже нескольких лет после курса лечения антибиотиками.
Иммунный ответ
В развитие боррелиозной инфекции, как правило, вовлечено несколько патогенных механизмов. Некоторые синдромы, такие как менингит и радикулит, вероятно, отражают результат прямой инфекции органа, а вот артрит и полиневрит могут быть связаны с непрямыми эффектами, вызванными вторичным аутоиммунным ответом.
Иммунный ответ организма на боррелиозную инфекцию проявляется по-разному. Для контроля над распространением инфекции организм использует как врожденный (неспецифическая резистентность), так и адаптивный специфический иммунный ответ, т. е. выработку специфических антител против инфекционного агента. В течение первых двух недель после начала болезни у большинства пациентов действительно обнаруживаются иммуноглобулины против определенных антигенов боррелий — инфекционных белков, запускающих в организме механизм иммунного ответа.
Еще в 90-х гг. прошлого века в США были проведены первые исследования, направленные на разработку антиборрелиозной вакцины. Но и на сегодняшний день эффективной вакцины, предохраняющей от этого опасного заболевания, не существует. Вероятно, трудности с получением безопасных вакцин имеют отношение к особенностям иммунного ответа, наблюдаемого при боррелиозной инфекции. Он может инициировать выработку антител против некоторых собственных белков организма, т. е. вызвать опасные аутоиммунные реакции.
Причиной подобного иммунного ответа является молекулярная мимикрия, сходство (например, между липопротеином боррелий OspA и белком адгезии hLFA-1α), который вырабатывается нашими Т-клетками в синовиальной оболочке, выстилающей внутренние поверхности суставов. Так, осложнения, возникающие после проведения вакцинации вакциной на основе липопротеина OspA, в большинстве случаев проявлялись в виде артритов и аутоиммунных ревматоидных артритов. Работа по созданию приемлемой, безвредной и в то же время эффективной вакцины продолжается до сих пор.
Как диагностировать ИКБ?
Диагностику ИКБ обычно проводят на основании так называемого эпидемиологического анамнеза (установления факта посещения леса, укуса клеща), а также клинических признаков заболевания, главным из которых является наличие мигрирующей эритемы.
Особую сложность для диагностики представляют заболевания, протекающие в безэритемных формах, одновременно с другими инфекциями, переносимыми клещами, например клещевым энцефалитом или анаплазмозом. В клинической практике известны случаи, когда у больного одновременно были выявлены безэритемная форма боррелиоза и клещевого энцефалита, которые привели его к повторной госпитализации по причине осложнений.
Случаи безэритемных форм можно диагностировать только с помощью лабораторных тестов. Выделение боррелий из проб кожи, проб сыворотки крови, спинномозговой или синовиальной жидкостей на специальные среды методом культивирования требует наличия специальных условий, дорогостоящих реактивов, занимает много времени, а главное — малоэффективно.
Первые исследования, направленные на разработку антиборрелиозной вакцины, были проведены еще в 90-х гг. прошлого века.
Но и на сегодняшний день эффективной вакцины против этого опасного заболевания не существует
Микроскопические исследования используются обычно при проведении анализа зараженности боррелиями клещей, но практически не применяются при диагностике ИКБ, поскольку в тканях и жидкостях организма инфицированного человека боррелии не накапливаются в таких количествах, чтобы их можно было обнаружить под микроскопом.
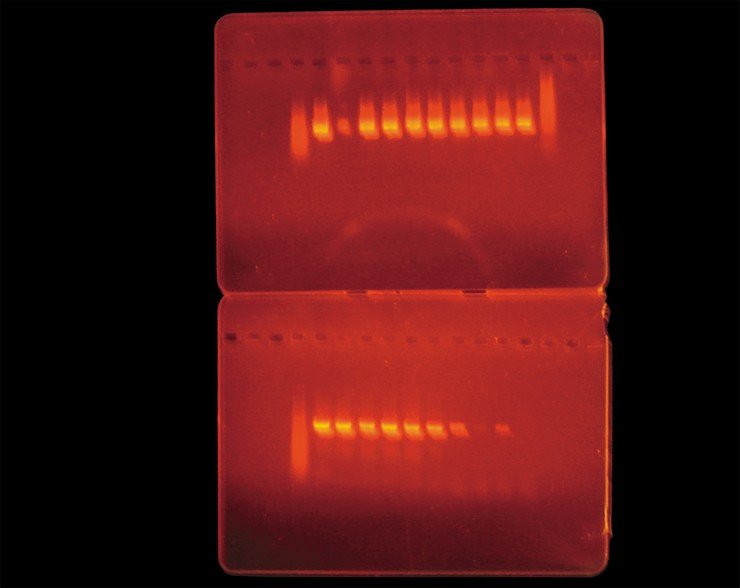
Для выявления боррелий может использоваться полимеразная цепная реакция (ПЦР), проведение которой позволяет обнаружить ДНК возбудителя. При проведении таких исследований нами было показано, что число боррелий, содержащихся в одном клеще, варьирует от одной до шести тысяч. Однако в настоящее время метод на основе ПЦР, как и все остальные методы диагностики боррелиоза, использовать в качестве самостоятельного теста для диагностики заболевания не рекомендуется, поскольку в данном случае чувствительность этого метода недостаточна, что может привести к так называемым «ложноотрицательным» результатам.
Тем не менее, при проведении совместных работ с Муниципальной инфекционной больницей № 1 г. Новосибирска было показано, что на ранней стадии болезни, до начала лечения, в комплексной диагностике заболевания метод ПЦР вполне применим наряду с иммунологическими методами анализа.
Для своевременного выявления смешанной инфекции определение ДНК необходимо проводить в первые четыре недели после присасывания клещей. Однако отрицательный результат, который при этом может быть получен, не исключает наличия заболевания и через 3—6 недель требует проведения серологических тестов (на специфические антитела).
Выявление антител к белкам боррелий сегодня и является основным способом лабораторной диагностики. В США и в странах Европы для повышения надежности серодиагностики боррелиоза было рекомендовано использовать двухступенчатую схему тестирования сывороток крови, однако в России двухступенчатый подход не применяется из-за отсутствия отечественных тест-систем. Кроме того, иммуноглобулины из сыворотки крови больных ИКБ могут по-разному реагировать с основными белками разных видов боррелий, поэтому критерии тестирования, разработанные для одной страны, могут быть непригодны для другой.
В России сейчас широко применяют серологические методы детекции: иммуноферментный анализ (ИФА) и реакцию непрямой иммунофлюоресценции (РНИФ), диагностическая значимость которых сопоставима. Однако применение второго метода может быть ограничено тем, что существует вероятность перекрестных реакций с близкородственными боррелиям микроорганизмами, в частности с Treponema palladium, возбудителем сифилиса. В целом же эффективность выявления у больных антител даже с помощью применения комбинации современных серологических тестов зависит от стадии заболевания.
Так что же такое боррелиоз — обычная инфекция или болезнь на всю жизнь? В действительности этот недуг не так безобиден, как представляется на первый взгляд.Иногда инфицирование организма боррелиями вызывает тяжелые отдаленные последствия, заболевания, которые только при ближайшем рассмотрении удается связать с боррелиозом, ранее перенесенным пациентами.
Благоприятный исход этого серьезного бактериального заболевания, переносимого клещами, во многом зависит от проведения своевременной, адекватной диагностики и соответствующей терапии. И лечение ИКБ должно заключаться не в бездумном приеме антибиотиков, как это иногда случается. Это — дело профессионалов, которые способны выявить не только клиническую симптоматику, но также индивидуальные особенности течения болезни и наличие сопутствующих заболеваний.
: 17 Июн 2007 , Нефть: герои не нашего времени , том 15, №3
Источник: scfh.ru
Опыт лечения гастроэзофагеальной рефлюксной болезни

Обеспечение эффективного контроля над желудочной секрецией — одно из главных условий успешной терапии так называемых «кислотозависимых» заболеваний верхних отделов желудочно-кишечного тракта. В клинической и поликлинической практике в настоящее время для
#06/02 Ключевые слова / keywords: Гастроэнтерология, Gastroenterology
2002-06-07 00:00
242253 прочтения
Обеспечение эффективного контроля над желудочной секрецией — одно из главных условий успешной терапии так называемых «кислотозависимых» заболеваний верхних отделов желудочно-кишечного тракта. В клинической и поликлинической практике в настоящее время для ингибирования соляной кислоты париетальными клетками слизистой оболочки желудка чаще всего используются блокаторы Н2-рецепторов гистамина второго (ранитидин) и третьего (фамотидин) поколений, несколько реже — ингибиторы протонного насоса (омепразол, рабепразол), а для нейтрализации уже выделенной в полость желудка соляной кислоты — антацидные препараты. Антацидные препараты иногда применяются в лечении больных, страдающих так называемыми «кислотозависимыми» заболеваниями, в сочетании с Н2-блокаторами рецепторов гистамина; иногда в качестве терапии по «требованию» в сочетании с ингибиторами протонного насоса. Одна или две «разжеванные» антацидные таблетки не оказывают значительного эффекта [10] на фармакокинетику и фармакодинамику фамотидина, применяемого в дозе 20 мг.
Между этими медикаментозными препаратами существуют определенные различия, перечислим основные из них: различные механизмы действия; скорость наступления терапевтического эффекта; продолжительность действия; разная степень эффективности их терапевтического действия в зависимости от времени приема препарата и приема пищи; стоимость медикаментозных препаратов [1]. Вышеперечисленные факторы не всегда учитываются врачами при лечении больных.
В последние годы в литературе все чаще обсуждаются вопросы фармакоэкономической эффективности использования в терапии «кислотозависимых» заболеваний различных медикаментозных препаратов, применяющихся по той или иной схеме [2, 7]. Стоимость обследования и лечения больных особенно важно учитывать в тех случаях, когда больные в силу особенностей заболевания нуждаются в продолжительном лечении [4, 6], например при гастроэзофагеальной рефлюксной болезни (ГЭРБ). Это весьма распространенное заболевание, обследование и лечение таких пациентов требуют значительных расходов.
Как известно, у большей части больных ГЭРБ отсутствуют эндоскопические признаки рефлюкс-эзофагита. Однако по мере прогрессирования ГЭРБ появляются патологические изменения слизистой оболочки пищевода. Симптомы этого заболевания оказывают на качество жизни такое же воздействие, что и симптомы других заболеваний, включая и ишемическую болезнь сердца [5].
Замечено [8] отрицательное воздействие ГЭРБ на качество жизни, особенно на показатели боли, психическое здоровье и социальную функцию. У больных, страдающих ГЭРБ, высок риск появления пищевода Барретта, а затем и аденокарциномы пищевода. Поэтому при первых же клинических симптомах ГЭРБ, особенно при возникновении эндоскопических признаков эзофагита, необходимо уделять достаточное внимание своевременному обследованию и лечению таких больных.
В настоящее время лечение больных ГЭРБ проводится, в частности, препаратом фамотидин (гастросидин) в обычных терапевтических дозировках (по 20 мг или по 40 мг в сутки). Этот препарат обладает рядом достоинств: удобство применения (1-2 раза в сутки), высокая эффективность в терапии «кислотозависимых» заболеваний, в том числе и по сравнению с антацидными препаратами [9], а также большая безопасность по сравнению с циметидином. Однако наблюдения показали [1], что в ряде случаев для повышения эффективности терапии целесообразно увеличение суточной дозы гастросидина, что, по некоторым наблюдениям [1], снижает вероятность появления побочных эффектов по сравнению с использованием в повышенных дозах блокаторов Н2-рецепторов гистамина первого (циметидин) и второго (ранитидин) поколений. Преимущество фамотидина [11] перед циметидином и ранитидином заключается в более продолжительном ингибирующем эффекте на секрецию соляной кислоты обкладочными клетками слизистой оболочки желудка.
Существуют и другие преимущества блокаторов Н2-рецепторов гистамина (ранитидина или фамотидина) перед ингибиторами протонного насоса; в частности, назначение этих препаратов на ночь позволяет эффективно использовать их в лечении больных из-за отсутствия необходимости соблюдать определенную «временную» связь между приемом этих препаратов и пищи. Назначение некоторых ингибиторов протонного насоса на ночь не позволяет использовать их на полную мощность: эффективность ингибиторов протонного насоса снижается, даже если эти препараты приняты больными вечером и за час до приема пищи. Однако суточное мониторирование рН, проведенное у больных, лечившихся омезом (20 мг) или фамотидином (40 мг), свидетельствует [3] о том, что продолжительность действия этих препаратов (соответственно 10,5 ч и 9,4 ч) не перекрывает период ночной секреции, и в утренние часы у значительной части больных вновь наблюдается «закисление» желудка. В связи с этим необходим и утренний прием этих препаратов.
Определенный научно-практический интерес вызывает изучение эффективности и безопасности использования фамотидина и омеза (омепразола) в более высоких дозировках при лечении больных, страдающих «кислотозависимыми» заболеваниями верхних отделов желудочно-кишечного тракта.
Нами изучены результаты клинико-лабораторного и эндоскопического обследования и лечения 30 больных (10 мужчин и 20 женщин), страдающих ГЭРБ в стадии рефлюкс-эзофагита. Возраст больных — от 18 до 65 лет. При поступлении в ЦНИИГ у 30 пациентов выявлены основные клинические симптомы ГЭРБ (изжога, боль за грудиной и/или в эпигастральной области, отрыжка), у 25 больных наблюдались клинические симптомы, в основном ассоциируемые с нарушением моторики верхних отделов желудочно-кишечного тракта (чувство быстрого насыщения, переполнения и растяжения желудка, тяжесть в подложечной области), обычно возникающие во время или после приема пищи. Сочетание тех или иных клинических симптомов, частота и время их возникновения, а также интенсивность и продолжительность у разных больных были различными. Каких-либо существенных отклонений в показателях крови (общий и биохимический анализы), в анализах мочи и кала до начала терапии не отмечено.
При проведении эзофагогастродуоденоскопии (ЭГДС) у 21 больного выявлен рефлюкс-эзофагит (при отсутствии эрозий), в том числе у 4 больных обнаружена рубцово-язвенная деформация луковицы двенадцатиперстной кишки и у одного больного — щелевидная язва луковицы двенадцатиперстной кишки (5 больных страдали язвенной болезнью двенадцатиперстной кишки, сочетающейся с рефлюкс-эзофагитом). Кроме того, у одной больной обнаружена пептическая язва пищевода на фоне рефлюкс-эзофагита и у 8 больных — эрозивный рефлюкс-эзофагит. У всех больных, по данным ЭГДС, обнаружена недостаточность кардии (в сочетании с аксиальной грыжей пищеводного отверстия диафрагмы или без нее).
В лечении таких пациентов использовался гастросидин (фамотидин) в дозировке 40-80 мг в сутки в течение 4 недель (первые 2-2,5 недели лечение проводилось в стационаре ЦНИИГ, в последующие 2 недели пациенты принимали гастросидин в амбулаторно-поликлинических условиях). Терапию гастросидином всегда начинали и продолжали при отсутствии выраженных побочных эффектов, пациентам назначали по 40 мг 2 раза в сутки в течение 4 недель; лишь при появлении диареи и крапивницы дозировку гастросидина уменьшали до 40 мг в сутки.
Исследование было выполнено с учетом критериев включения и исключения больных из исследования согласно правилам клинической практики.
При проведении ЭГДС определяли НР, используя быстрый уреазный тест (один фрагмент антрального отдела желудка в пределах 2-3 см проксимальнее привратника) и гистологическое исследование биопсийного материала (два фрагмента антрального отдела в пределах 2-3 см проксимальнее привратника и один фрагмент тела желудка в пределах 4-5 см проксимальнее угла желудка). При обследовании больных при необходимости проводили УЗИ органов брюшной полости и рентгенологическое исследование желудочно-кишечного тракта. Полученные данные, включая и выявленные побочные эффекты, регистрировали в истории болезни.
В период проведения исследования больные дополнительно не принимали ингибиторы протонного насоса, блокаторы Н2-рецепторов гистамина или другие так называемые «противоульцерогенные» препараты, включая антацидные препараты и средства, содержащие висмут. 25 из 30 пациентов (84%) из-за наличия клинических симптомов, ассоциируемых чаще всего с нарушением моторики верхних отделов пищеварительного тракта, дополнительно получали прокинетики: домперидон (мотилиум) в течение 4 недель или метоклопрамид (церукал) в течение 3-4 недель.
Лечение больных ГЭРБ в стадии рефлюкс-эзофагита всегда начинали с назначения им гастросидина по 40 мг 2 раза в сутки (предполагалось, что в случае появления существенных побочных эффектов доза гастросидина будет уменьшена до 40 мг в сутки). Через 4 недели от начала лечения (с учетом состояния больных) при наличии клинических признаков ГЭРБ и (или) эндоскопических признаков эзофагита терапию продолжали еще в течение 4 недель. Через 4-8 недель по результатам клинико-лабораторного и эндоскопического обследования предполагалось подвести итоги лечения больных ГЭРБ.
При лечении больных гастросидином (фамотидином) учитывались следующие факторы: эффективность гастросидина в подавлении как базальной и ночной, так и стимулированной пищей и пентагастрином секреции соляной кислоты, отсутствие изменений концентрации пролактина в сыворотке крови и антиандрогенных эффектов, отсутствие влияния препарата на метаболизм в печени других лекарственных средств.
По результатам анализа обследования и лечения больных ГЭРБ в стадии рефлюкс-эзофагита в большинстве случаев терапия была признана эффективной. На фоне проводимого лечения у больных ГЭРБ с рефлюкс-эзофагитом (при отсутствии эрозий и пептической язвы пищевода) основные клинические симптомы исчезали в течение 4-12 дней; у пациентов с эрозивным рефлюкс-эзофагитом боль за грудиной постепенно уменьшалась и исчезала на 4-5-й день от начала приема гастросидина; у больной с пептической язвой пищевода на фоне рефлюкс-эзофагита — на 8-й день.
Двое из 30 больных (6,6%) через 2-3 дня от начала лечения отказались от приема гастросидина, с их слов, из-за усиления болей в эпигастральной области и появления тупых болей в левом подреберье, хотя объективно состояние их было вполне удовлетворительным. Эти больные были исключены из исследования.
По данным ЭГДС, через 4 недели лечения у 17 пациентов из 28 (60,7%) исчезли эндоскопические признаки рефлюкс-эзофагита, у 11 — отмечена положительная динамика — уменьшение выраженности эзофагита. Поэтому в дальнейшем этих больных лечили гастросидином в амбулаторно-поликлинических условиях в течение еще 4 недель по 40 мг 2 раза в сутки (7 больных) и по 40 мг 1 раз в сутки (4 больных, у которых ранее была снижена дозировка гастросидина).
Весьма спорным остается вопрос — рассматривать ли рефлюкс-эзофагит, нередко наблюдаемый при язвенной болезни (чаще всего при язвенной болезни двенадцатиперстной кишки), как осложнение этого заболевания или же считать его самостоятельным, сопутствующим язвенной болезни заболеванием? Наш многолетний опыт наблюдений показывает, что, несмотря на некоторую связь ГЭРБ и язвенной болезни (их относительно частое сочетание и даже появление или обострение рефлюкс-эзофагита в результате проведения антихеликобактерной терапии), все же язвенную болезнь и ГЭРБ (в том числе и в стадии рефлюкс-эзофагита) следует считать самостоятельными заболеваниями. Мы неоднократно наблюдали больных с частыми обострениями ГЭРБ в стадии рефлюкс-эзофагита (при наличии у них рубцово-язвенной деформации луковицы двенадцатиперстной кишки). Последнее обострение язвенной болезни (с образованием язвы в луковице двенадцатиперстной кишки) у этих больных отмечалось 6-7 и более лет назад (значительно реже, чем рецидивы ГЭРБ в стадии рефлюкс-эзофагита), однако при очередном обострении язвенной болезни с образованием язвы в луковице двенадцатиперстной кишки всегда при эндоскопическом исследовании выявляли и рефлюкс-эзофагит. Мы уверены, что при наличии современных медикаментозных препаратов лечить неосложненную язвенную болезнь значительно легче, чем ГЭРБ: период терапии при обострении язвенной болезни двенадцатиперстной кишки занимает значительно меньше времени по сравнению с терапией ГЭРБ; да и в период ремиссии этих заболеваний пациенты с язвенной болезнью двенадцатиперстной кишки чувствуют себя более комфортно, в то время как больные ГЭРБ вынуждены для улучшения качества жизни отказываться от приема значительно большего количества продуктов и напитков.
При обследовании (через 8 недель лечения) трое из 11 больных по-прежнему предъявляли жалобы, ассоциированные с нарушением моторики верхних отделов желудочно-кишечного тракта. Трое больных при хорошем самочувствии отказались от проведения контрольной ЭГДС через 8 недель. По данным ЭГДС, у 7 из 8 больных отмечено исчезновение эндоскопических признаков эзофагита (в том числе у одной больной — заживление пептической язвы пищевода).
Определение НР проводилось у всех 30 больных: в 11 случаях выявлена обсемененность НР слизистой оболочки желудка (по данным быстрого уреазного теста и гистологического исследования материалов прицельных гастробиопсий). Антихеликобактерная терапия в период лечения больным ГЭРБ в стадии рефлюкс-эзофагита не проводилась.
При оценке безопасности проведенного лечения каких-либо значимых отклонений в лабораторных показателях крови, мочи и кала отмечено не было. У 4 больных (13,3%), у которых ранее наблюдался «нормальный» (регулярный) стул, на 3-й день лечения гастросидином (в дозе 40 мг 2 раза в сутки) был отмечен, с их слов, «жидкий» стул (кашицеобразный, без патологических примесей), в связи с чем доза гастросидина была уменьшена до 40 мг в сутки.
Через 10-12 дней после снижения дозы стул нормализовался без какой-либо дополнительной терапии. Интересно отметить, что еще у 4 больных, которые ранее страдали запорами, на фоне проводимого лечения стул нормализовался на 7-й день. У 3 из 30 больных (10%) на 3-4-й день приема гастросидина появились высыпания на коже туловища и конечностей (крапивница). После уменьшения дозировки гастросидина до 40 мг в сутки и проведения дополнительного лечения диазолином (по 0,1 г 3 раза в день) высыпания на коже исчезли.
Проведенные исследования показали целесообразность и эффективность терапии ГЭРБ в стадии рефлюкс-эзофагита гастросидином по 40 мг 2 раза в сутки, особенно при лечении больных с выраженными болевым синдромом и изжогой. Такое лечение может успешно проводиться в стационарных и амбулаторно-поликлинических условиях. Изучение отдаленных результатов проведенного лечения позволит определить продолжительность периода ремиссии этого заболевания и целесообразность лечения гастросидином в качестве «поддерживающей» терапии или же терапии «по требованию».
По вопросам литературы обращайтесь в редакцию
Источник: www.lvrach.ru