1) Борная кислота используется при эмалировании железных сосудов (вводится в состав эмалей) и в медицине (дезинфицирующие полоскания и т. д.), а также служит обычным исходным продуктом для получения остальных соединений бор»а. Бура применяется в ряде отраслей промышленности – стекольной, керамической, кожевенной и др. – из медицине.
В свободном состоянии бор может быть получен из борной кислоты. Нагреванием ее переводят в борный ангидрид (В2 О3 ), который затем накаливают с металлическим магнием:
После обработки продуктов реакции соляной кислотой (для удаления MgO) остается элементарный бор В чистом состоянии он имеет черный цвет, плотность 2,3, плавится при 2075°С и кипит при 3960°С.
В обычных условиях бор весьма инертен. Напротив, при высоких температурах он соединяется не только с кислородом, хлором и бромом, но также с серой и азотом. При очень сильном накаливании бор вытесняет свободные элементы даже из таких устойчивых окислов, как Р2 О5 , СО2 и SiO2 , а также из окислов многих металлов. При сплавлении бора с некоторыми из последних образуются бориды этих металлов, например борид магния – Mg3 B2 .
Как сделать отбеливатель в майнкрафте?
По отношению к воздуху и воде бор вполне устойчив. В обычных кислотах он не растворяется, но горячая концентрированная HNO3 постепенно окисляет его до борной кислоты:
Во всех устойчивых соединениях бор трехвалентен.
Наиболее характерны для бора кислородные соединения. При нагревании на воздухе до 700°С он сгорает по уравнению:
Образующийся борный ангидрид представляет собой бесцветную, довольно тугоплавкую стекловидную массу.
На воздухе В2 О3 притягивает влагу, а в воде растворяется с образованием борной кислоты.
Борная (точнее – ортоборная) кислота представляет собой бесцветные кристаллы. При нагревании она теряет воду и переходит сначала в метаборную кислоту (НВО2 ), затем в тетраборную (Н2 В4 О7 ) и, наконец, в борный ангидрид. Растворение этих веществ в воде сопровождается их переходом в Н3 ВО3 .
Диссоциация гидрата В(ОН)3 в растворе идет по кислотному типу. Однако борная кислота очень слаба и поэтому из растворов своих солей легко выделяется большинством других кислот. Соли ее (борнокислые, или бораты) производятся обычно от различных полиборных кислот общей формулы xВ2 О3 ·yН2 О, чаще всего – тетраборной (х = 2, y = 1). Последняя является кислотой значительно более сильной, чем ортоборная.
Избытком щелочи они могут быть переведены в метабораты: 2NaOH + Na2 B4 O7 = 4NaBO2 + Н2 О
С другой стороны, при действии на тетрабораты (или метабораты) сильных кислот выделяется свободная ортоборная кислота:
В воде из боратов растворимы только соли наиболее активных одновалентных металлов. Вследствие гидролиза растворы их показывают сильнощелочную реакцию. Важнейшим для практики боратом является бура.
Так как безводные бораты чрезвычайно устойчивы по отношению к нагреванию, при высоких температурах борная кислота выделяет большинство других кислот из их солей. В этом отношении (как и по своей слабости) она похожа на кремневую кислоту.
как сделать триоксид бора
2) Борная кислота (K1 = 6·10 –10 , K2 = 2·10 – 13 , K3 = 2·10 –14 ) окрашивает пламя в зеленый цвет и несколько летуча с водяным паром, Тетраборной кислоте (K1 = 2·10 –4 , K2 = 2·10 –5 ) может быть придана структурная формула:
Из солей различных полиборных кислот многие встречаются в природе и служат исходными продуктами для получения соединений бора.
3) Сульфид бора (B2 S3 ) образуется в виде бесцветной стекловидной массы при накаливании бора в парах серы. Водой он полностью разлагается на борную кислоту и H2 S. С азотом бор соединяется только выше 1200 °С. Нитрид бора (BN) представляет собой белый порошок, плавящийся лишь около 3000 °С (под давлением). По кристаллической структуре BN сходен с графитом.
Карбид бора (В4 С) образуется в виде черных блестящих кристаллов принакаливании смеси бора (или В2 О3 ) с углем в электрической печи. Он отличается тугоплавкостью (т. пл. 2550 °С) и чрезвычайной твердостью (близкой к твердости алмаза). И нитрид и карбид бора характеризуются большой устойчивостью по отношению к различным химическим воздействиям.
Галоидные соединения бора общей формулы ВГ3 могут быть получены путем взаимодействия элементов при нагревании. Они представляют собой бесцветные вещества. При обычных условиях BF3 газообразен, ВСl3 кипит при + 18°С, ВВr3 – жидкость и BJ3 –твердое тело. В водном растворе все они подвергаются гидролизу по схеме:
Для галогенидов бора весьма характерны реакции присоединения к ним молекул различных других веществ. В частности, фтористый бор образует продукт присоединения с HF:
Комплексная борофтористоводородная кислота (HBF4 ) устойчива только в растворе, причем ее кислотные свойства выражены значительно сильнее, чем у HF. Большинство солей HBF4 (фтороборатов) бесцветно и легкорастворимо в воде. Как и в случае кремния, аналогичные производные с другими галоидами не образуются.
4) Строение молекул галогенидов ВГ3 отвечает плоскому треугольнику с атомом В в центре. Некоторые их свойства сопоставлены ниже:
При образовании галогенидами бора комплексов с другими веществами атом В выступает в качестве акцептора (IX § 2 доп. 1). Поэтому присоединяться к молекулам ВГ3 способны только молекулы, содержащие атом с достаточно отчетливо выраженной до норной функцией.
По ряду F–Сl–Br–J склонность молекул ВГз к комплексообразованию довольно быстро уменьшается. Фтористый бор является хорошим катализатором различных органических реакций. Вследствие образования HBF4 гидролиз BF3 идет несколько иначе, чем в случае остальных галогенидов бора, а именно по суммарной схеме: 4BF3 + 3H2 O = 3HBF4 + B(OH)3 .
С водородом бор не соединяется, однако при действии кислот на Mg3 B2 одновременно со свободным Н2 выделяются небольшие количества смеси различных бороводородов (иначе, боранов), среди которых преобладает В4 Н10 . Последний легко распадается на В2 Н6 и ряд других боранов, более бедных водородом.
Бораны бесцветны и по физическим свойствам очень похожи на углеводороды и силаны аналогичного состава, как это видно из приводимого ниже сопоставления:
По химическим свойствам они похожи на силаны. Так же как и последние (и даже в еще большей степени), бораны при обычных условиях неустойчивы. В частности, водой они постепенно разлагаются с выделением водорода по реакции, например
а получаемая при разложении Mg3 B2 кислотами газовая смесь на воздухе самовоспламеняется. Горение боранов сопровождается выделением огромного количества тепла (484 ккал/моль В2 Н6 ), что создает возможность их использования в качестве очень эффективного ракетного топлива.
5) Так как бор трехвалентен, его водородными соединениями должны были бы быть такие молекулы, как ВН3 , В2 Н4 , В3 Н5 и т. д. Между тем бораны подобного состава неизвестны.
Молекулы летучих бороводородов следует, по–видимому, рассматривать как результат сочетания друг с другом приведенных выше валентнонасыщенных структур при посредстве особого рода водородных связей. Так, строение В2 Н6 и В4 Н10 выражается с этой точки зрения следующими схемами:
Лучше других изучены шесть бороводородов, температуры плавления и кипения которых приводятся ниже:
Все эти бораны имеют отвратительный запах и очень ядовиты.
Еще по теме:
Источник: xumuk.ru
Триоксид бора в майнкрафте как сделать
Растворимость в воде (при 25°C), г/л
Как следует из таблицы 1, при переходе от макро- до нано-состояния температура плавления увеличилась на 60 °C, при этом температура кипения наоборот, уменьшилась на 240 °C, что составляет 13% и 11,4% от изначальных соответственно. Также изменилась плотность, с 2,56 г/см3 на 2,46 г/см3, то есть на 3,9%. Кроме того, изменилась растворимость в воде, а именно уменьшилась на 10%.
Растворимость — это способность вещества образовывать гомогенные смеси с дисперсным распределением компонентов (растворы); определяется в граммах, полностью растворенных в литре вещества при определенной температуре [10]. Оксид бора по принятой классификации относится к хорошо растворимым веществам (растворимость больше 10 г/л). Так как необходимо сравнить со значением растворимости нанопорошка при 25°C, а известна растворимость макроструктуры при 20 и 100°C [7], то использовался метод интерполяции для получения растворимости при 25°C. Таким образом, растворимость оксида бора в воде с уменьшением размеров частиц уменьшилась на 10%.
Наибольшее значение на изменение свойств оксида бора в наноструктуре оказывают квантовые размерные эффекты. Из сравнения размеров частицы нанопорошка (20 нм) с длиной волны Де Бройля для полупроводников λБ=10-100 нм можно сделать вывод, что квантовые размерные эффекты могут оказывать существенное влияние, поскольку размер наночастицы приближается к меньшему размеру длины волны Де Бройля. К этому же выводу мы приходим, исходя из сравнения температур плавления макро- и наноструктур, т.к. она выросла по сравнению с макроструктурой, а также твердость осталась неизменной.
Не следует исключать влияние классических размерных эффектов. К влиянию классических размерных эффектов относится уменьшение температуры кипения, кроме того, сказывается также влияние приповерхностной зоны.
Применение. Оксидные соединения являются веществами, не проводящими электричество. Однако некоторые соединения, в том числе оксид бора, имея особую фазовую структуру, могут использоваться в твердых оксидных электродах топливных элементов и системах генерации кислорода [9].
Нанопорошок оксида бора применяется в нейтронно-захватной терапии раковых клеток, получении водорода из воды, а также топлива с высокой плотностью энергии. В основном используются для изготовления изоляторов плазменной дуги, материалов для высокочастотных индукционных печей, полупроводниковых твердофазных примесей, материалов конструкции атомных реакторов, в качестве термоядерного реагента при разложении силикатов, добавки в жаропрочную стеклянную посуду, огнеупорные краски и в качестве присадки к смазочным материалам, применяемым при высоких температурах.
Нанопорошок чистого оксида бора необходим для производства некоторых типов стекол, включая оптические и телескопические линзы с высоким показателем преломления и низкими рассеивающими свойствами [11], прочные медицинские стекла (ампулы) и стеклокерамические композиты. Известно, что по оптическим свойствам комплексные соединения, образованные оксидом бора с прочими оксидами, превосходят другие оптические материалы для передачи информации.
Были проведены многочисленные исследования по способам изготовления специальных стекол из оксида бора и изучены их оптические и другие свойства. И в этих исследованиях особую роль играли стекла именно с нанопорошковым ангидридом бора. В процессе производства некоторых нанокомпозитов и стекол для различных оптических волокон используются наночастицы оксида бора и боросиликатные соединения. И в зависимости от соотношения концентраций этих компонентов стекла приобретают наилучшие свойства [9].
Общие преимущества использования B2O3 в составе стекла заключаются в снижении температуры плавления, повышенном термическом сопротивлении и механической прочности, а также повышенной водной, химической стойкости. А высокая структурная стабильность при радиационном облучении оксида бора и других его соединений [12, 13] обуславливает его применение в космической промышленности [9].
Оксид бора применяется в производстве стекловолокна. Стекловолокно представляет собой волокна или нити, изготовленные из стекла или его производных, но благодаря сложному процессу производства приобретает уникальные свойства, нехарактерные для обычного стекла. Стекловолокно не разбивается при ударе, легко гнется, не деформируясь и не разрушаясь.
Используется для изготовления стройматериалов, а также различных высокотехнологичных и прочных легких конструкций. Боросодержащее стекловолокно содержит 5-6 масс.% оксида бора. Прочность на разрыв составляет 3100-3800 МПа, модуль упругости 76-78 Гпа [15].
Также используется при производстве полупроводниковых материалов (в качестве легирующей примеси) и литейных изделий, например, стали, которые требуют устойчивости к высоким температурам, истиранию и коррозии.
Оксид бора участвует при синтезе многих соединений бора. Уникальный потенциал и свойства наноразмерного оксида бора в этих процессах являются предметом пристального внимания инженерных и академических кругов. В частности, оксид бора может использоваться при одной из двух стадий для получения нанопорошков бора механохимическим методом [13].
Спрессованные нанопорошки высокой чистоты используются при создании мишеней для распыления физическим и химическим способом осаждения из паровой фазы, включая простое термическое, электронно-лучевое, низкотемпературное (для органических веществ), послойное атомное осаждение и химическое осаждение металло-органики из паровой фазы. Кроме того, оксид бора является катализатором синтеза органических соединений [9].
Ещё одно интересное применение описывается в работе [14]. Полученные химическим способом ультрадисперсные алмазы (УДА) используют в технологиях производства гальванических покрытий, в компактированных изделиях, алмазных полировальных пастах и прочих композиционных материалах.
Однако свойства конечного продукта могут варьироваться благодаря их сильной зависимости от введенных тем или иным способом примесей. По большей части, свойства меняются в отрицательную сторону. И одним из методов их стабилизации является введение стеклообразующих оксидов, а именно наноразмерного B2O3. Он замедляет окисление, а также уменьшает степень графитизации алмазов, что позволяет повысить температуру для компактирования.
Получение. Сонохимический синтез — это процесс, который использует принципы сонохимии, чтобы заставить молекулы подвергаться химической реакции с применением мощного ультразвукового излучения (20 кГц – 10 МГц). Сонохимия создает горячие точки, которые могут достигать очень высоких температур (5000–25000K), давление более 1000 атмосфер, а скорости нагрева и охлаждения могут превышать 10-11 К/с. Ультразвук высокой интенсивности производит химические и физические эффекты, которые можно использовать для производства или модификации широкого спектра наноструктурированных материалов. Принцип, который вызывает модификацию наноструктур в сонохимическом процессе, — это акустическая кавитация [16]. Пример установки сонохимического синтеза вы можете увидеть на рисунке 4.
С жидкостями, содержащими твердые частицы, подобные явления могут возникать при воздействии ультразвука. Когда кавитация возникает около протяженной твердой поверхности, схлопывание полости становится несферическим и приводит к выбросу высокоскоростных струй жидкости на поверхность. Эти струи и связанные с ними ударные волны могут повредить сильно нагретую поверхность. Суспензии жидкого порошка вызывают столкновения частиц с высокой скоростью. Эти столкновения могут изменить морфологию поверхности, состав и реакционную способность [17].

Рис. 4 — Пример сонохимической установки. [18]
В механохимическом синтезе тепло не используется для химических реакций, что делает его очень подходящим для производства керамики, которая окисляется или разрушается при высокой температуре (например, карбидов и силикатов). Исходные реагенты помещаются в высокоэнергетическую мельницу, где происходят химические изменения, вызванные механическим воздействием в условиях высокой нагрузки и скорости деформации в точках контакта между измельчающими средами. Из-за необходимости выдерживать эти суровые условия, метод подходит только для производства небольших объемов материалов (несколько сотен граммов порошка) [1].
Механохимия радикально отличается от традиционных способов растворения, нагревания и перемешивания химикатов в растворе. Поскольку механохимия устраняет необходимость во многих растворителях, она может помочь сделать многие химические процессы, используемые в промышленности, более экологически безопасными.
Пластическая деформация твердого тела обычно приводит не только к изменению формы твердого тела, но и к накоплению в нем дефектов, изменяющих физико-химические свойства, в том числе реакционную способность. Накопление дефектов используют в химии для ускорения реакций с участием твердых веществ, снижения температуры процессов и других путей интенсификации химических реакций в твердой фазе.
Механохимическим методом производят деструкцию полимеров, синтез интерметаллидов и ферритов, получают аморфные сплавы, активируют порошковые материалы [19].
Заключение. В ходе написания статьи был проведен сравнительный анализ свойств оксида бора в макро- и наноструктурах.
Очевидно, что обработка более массивных, объемных частиц оксида бора требует высоких температур плавления и спекания, а также специального оборудования, что не очень выгодно производителям. Таким образом, изготовление наноразмерного B2O3 является необходимым и полезным процессом, а исследование свойств и сравнение макро- и наноструктуры в данной работе достаточно значимы.
Источник: eduherald.ru
Все рецепты стали майнкрафт
Все химические соединения и крафты Minecraft Education Edition
Доброго времени суток, дорогие читатели! 3 года назад, мае 2018 года вышла версия Minecraft Bedrock 1.4.0, в которой помимо морского обновления разработчики добавили еще и новую функцию — Education Edition, где появились химические соединения и крафты. Сегодня мы как раз и рассмотрим их.
Чтоб включить возможно играться с химическими элементами, надо при создании мира долистать до кнопки Education Edition и активировать ее:
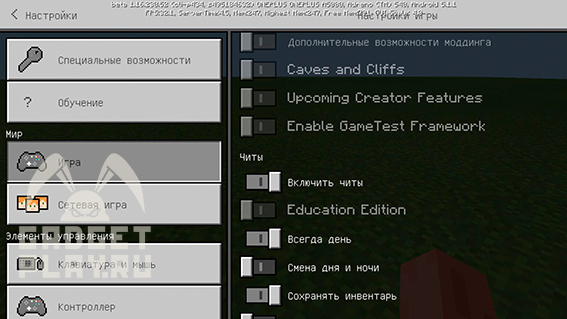
Будет предупреждение, мол, будьте осторожны, нужно мощное устройство и т.д., и т.п., но если у вас реально слабый гаджет, и в обычном мире игра либо сразу вылетает, либо жутко лагает, попробуйте включить эту функцию, создав плоский мир и попробуйте немного понизить настройки графики.
Ну а теперь, давайте приступим к лабораторной работе, так сказать.
Как соединять элементы
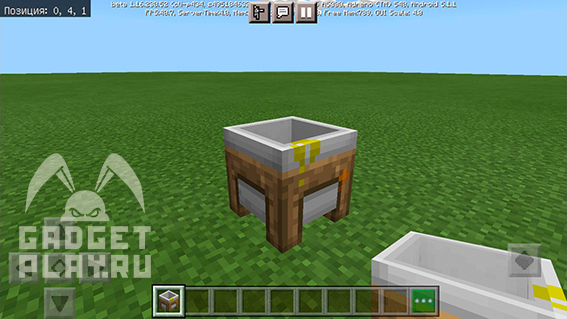
Чтобы соединять химические элементы и получать соединения, нужен создатель соединений, выглядит он вот так:
Попробуем, например, сделать воду. Ее химическая формула — H2O
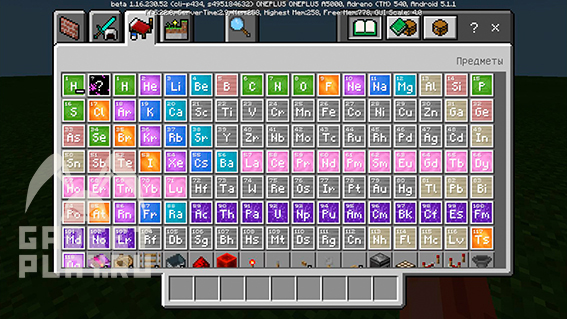
Нам доступны все химические элементы, которые есть в периодической системе Менделеева, и в данном случае нам надо найти 2 элемента: водород и кислород.

Соединять в создателе соединений нужно столько блоков элемента, сколько атомов в соединении.
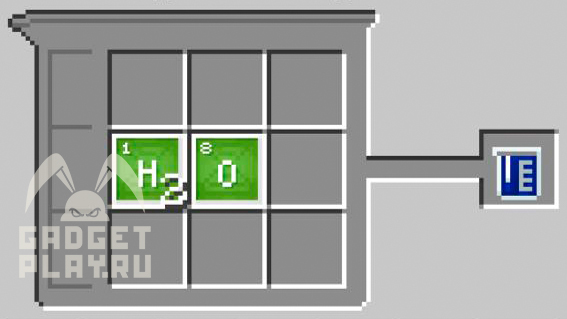
Вода содержит 2 атома водорода, 1 атом кислорода, значит в создателе соединений помещаем 2 блока водорода и блок кислорода, и получим воду. Аналогичным образом поступаем с остальными соединениями.
Оксид алюминия
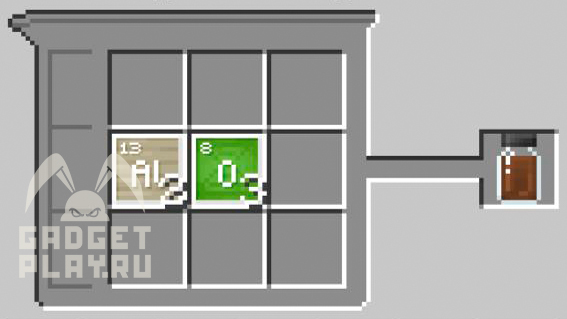
Чтоб получить оксид алюминия, нам нужно в создателе соединений поместить 2 атома алюминия и 3 атома кислорода.
Аммиак
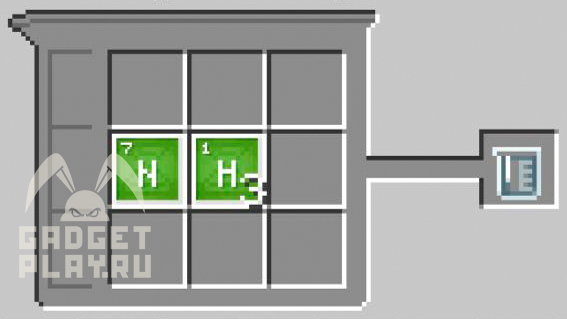
Соединяем 1 атом азота и 3 атома водорода
Сульфат бария
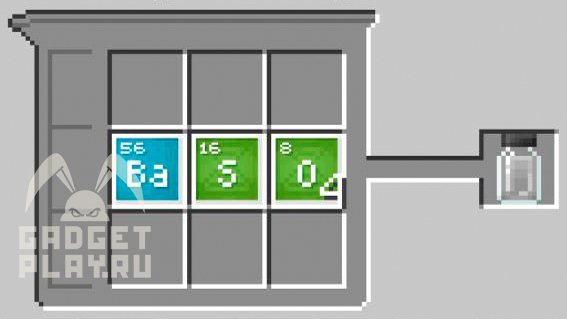
Для получения сульфата бария соединяем 1 атом бария, 1 атом серы, 4 атома кислорода.
Бензол
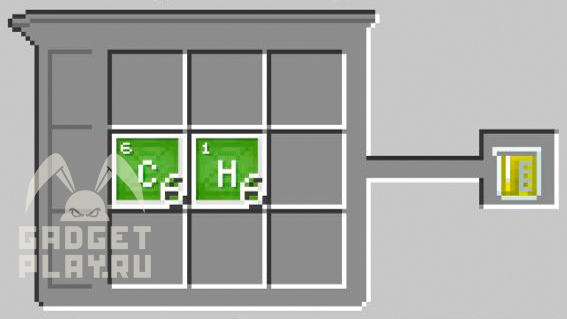
Соединяем 6 атомов углерода и 6 атомов водорода.
Триоксид бора
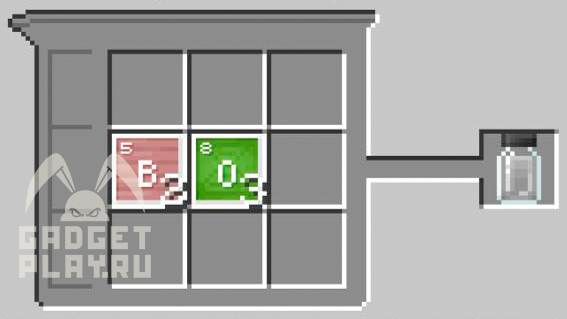
Соединяем 2 атома бора и 3 атома кислорода.
Бромид кальция
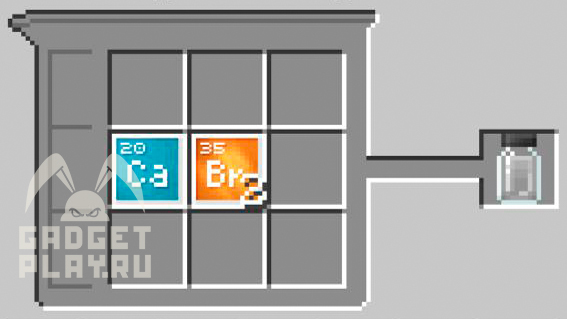
Соединяем 1 атом кальция, 2 атома брома.
Нефть
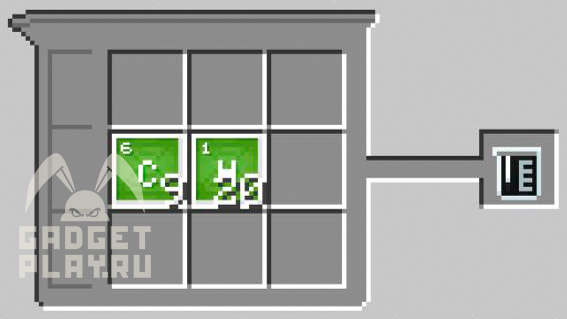
9 атомов углерода, 20 атомов водорода.
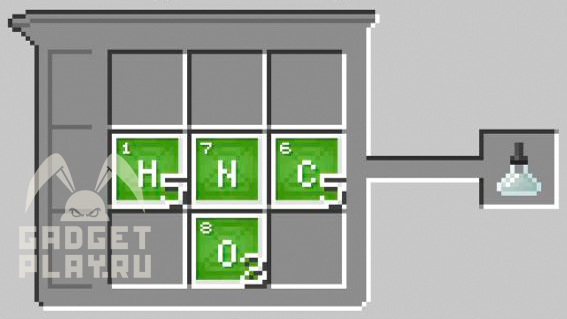
5 атомов углерода и 5 атомов водорода, 1 атом азота, 2 атома кислорода.
Пероксид водорода
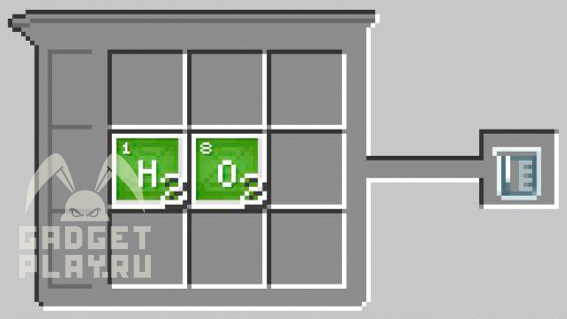
2 атома водорода и 2 атома кислорода.
Сульфид железа
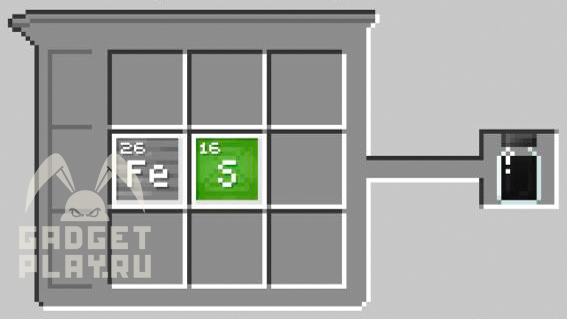
1 атом железа, 1 атом серы.
Латекс
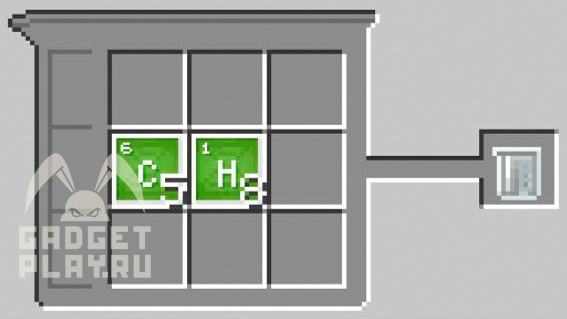
5 атомов углерода и 8 атомов водорода.
Гидрид лития
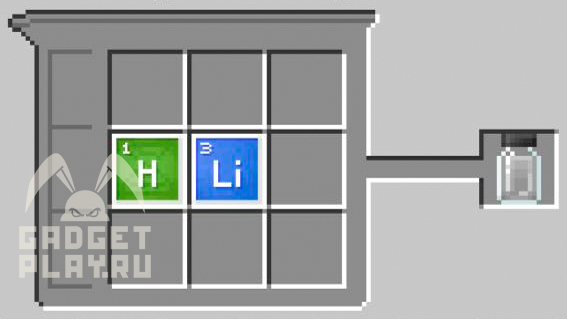
1 атом лития, 1 атом водорода.
Люминол
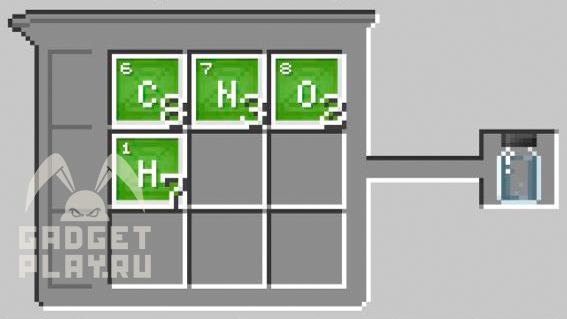
8 углерода, 7 водорода, 3 азота, 2 кислорода.
Щёлочь
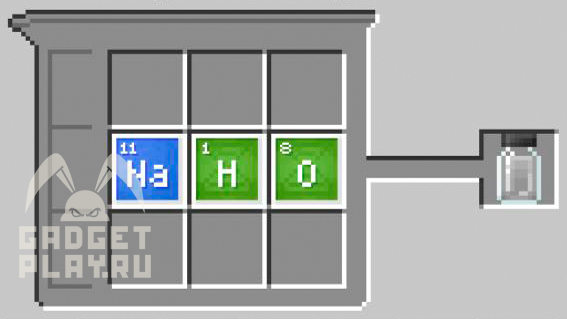
1 атом натрия, 1 атом кислорода, 1 атом водорода.
Нитрат магния
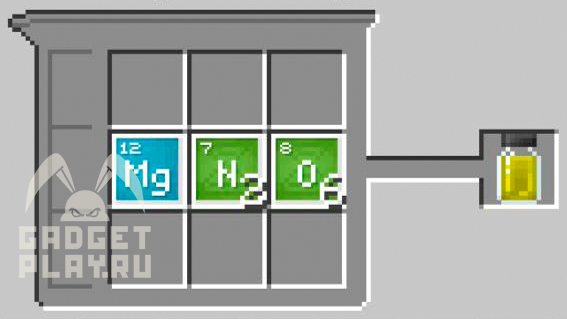
1 магний, 2 азота, 6 кислорода.
Оксид магния
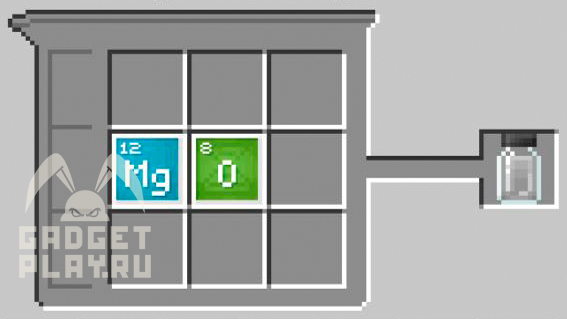
Полиэтилен
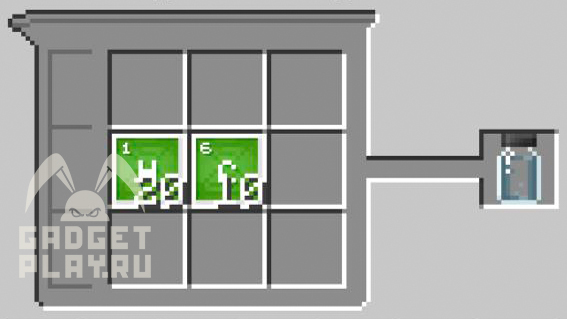
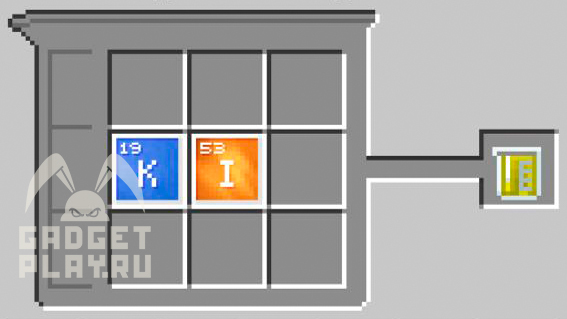
Иодид калия
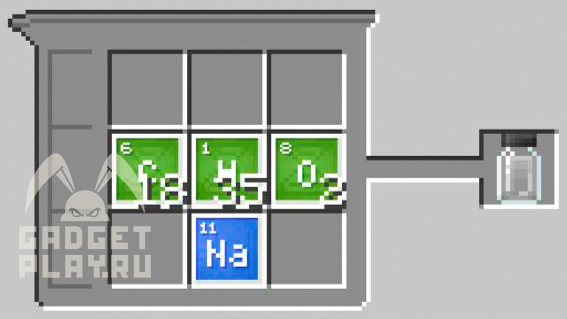
18 углерода, 35 водорода, 1натрий, 2 кислорода.
Ацетат натрия
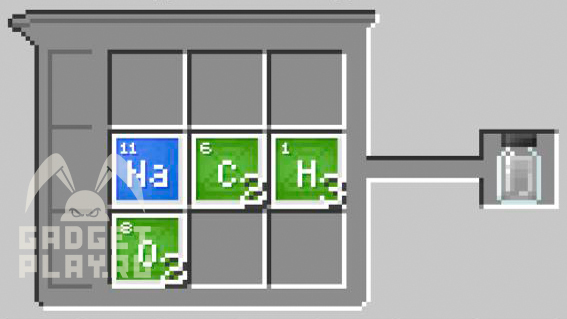
2 углерода, 3 водорода, 1 натрий и 2 кислорода.
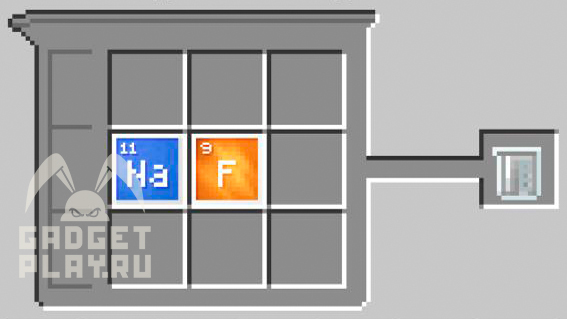
Фторид натрия
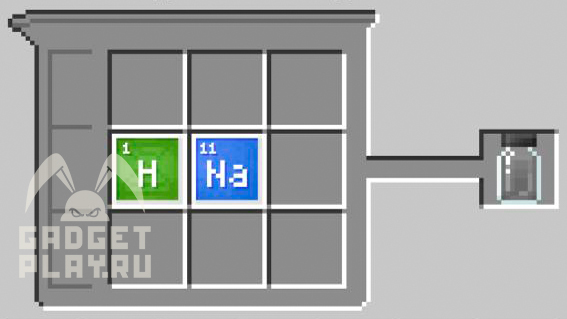
Гидрид натрия
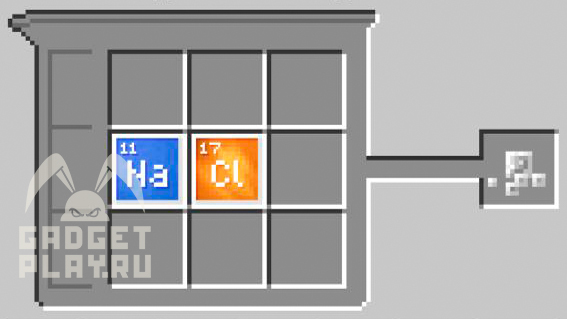
Гипохлорит натрия
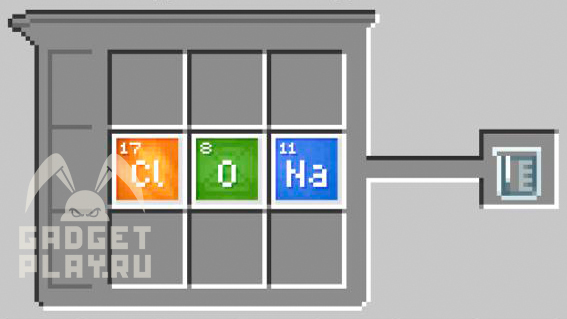
1 натрий, 1 хлор, 1 кислород.
Оксид натрия
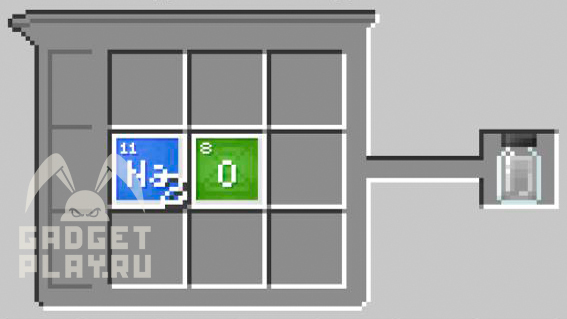
Сульфат
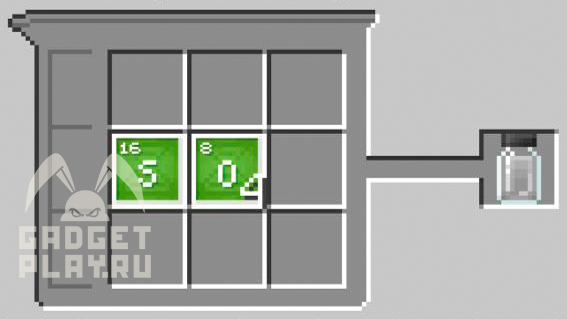
Хлорид кальция
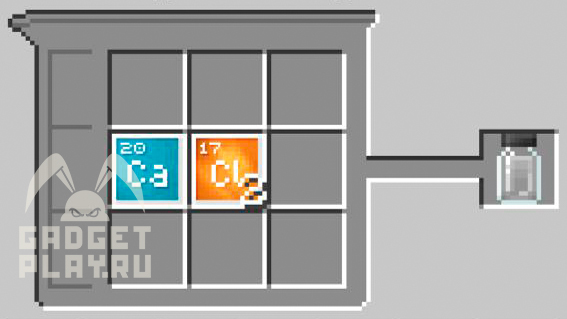
Хлорид церия
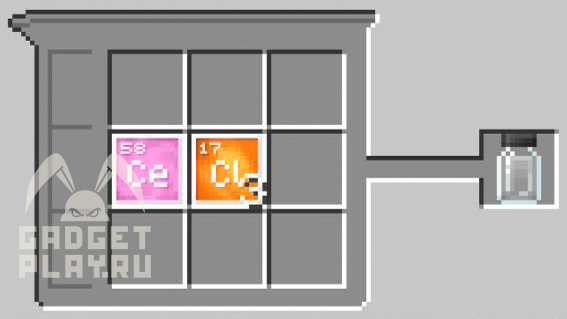
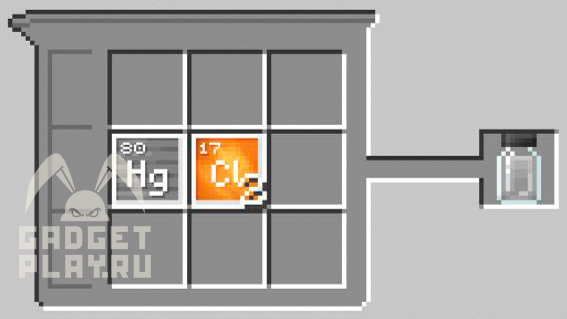
Хлорид ртути
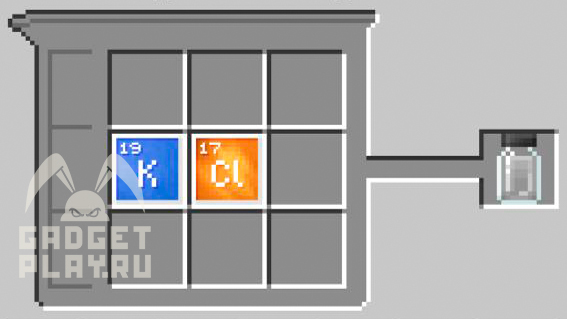
Хлорид калия
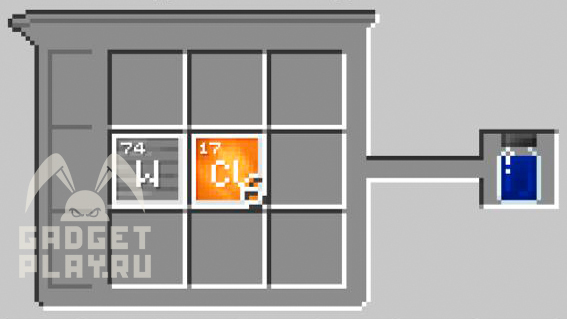
Хлорид вольфрама
Природные соединения
помимо вышеперечисленных, можно еще сделать соединения, которые можно добыть естественным путём, а именно, это такие соединения, как:
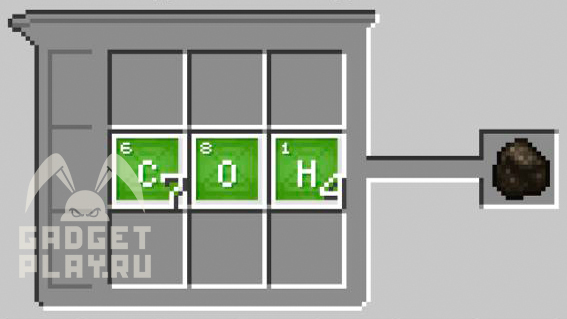
Древесный уголь. Соединяем 7 углерода, 4 водорода и 1 кислород.
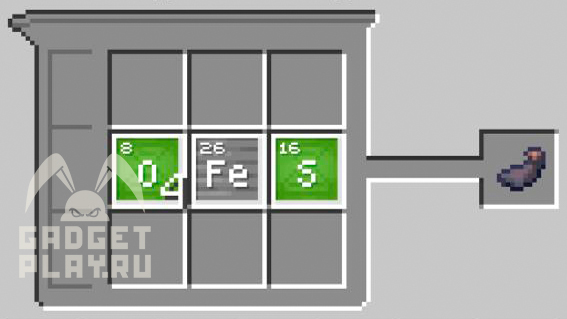
Чернила. 1 железо, 1 сера и 4 кислорода.
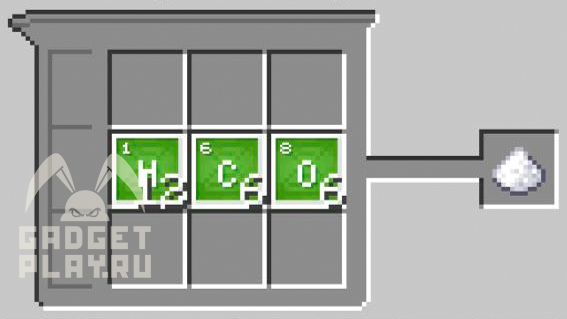
Сахар. 6 углерода, 12 водорода, 6 кислорода.
Крафты
Если мы создали так много соединений, значит пришла пора их использовать в крафте. Ниже перечислены крафты.
Воздушный шар

На скриншоте выше показан крафт воздушного шарика. Можете покрасить его в любой цвет. По бокам располагаем по три латекса.
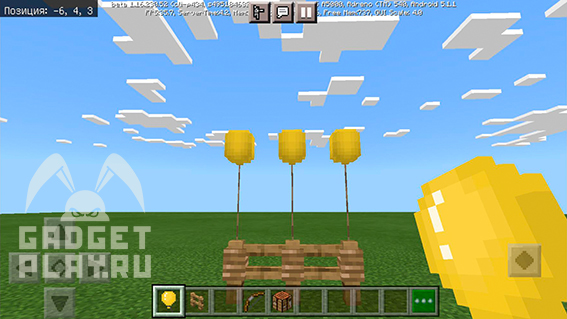
Также вы можете привязать воздушный шар к забору, либо мобам.
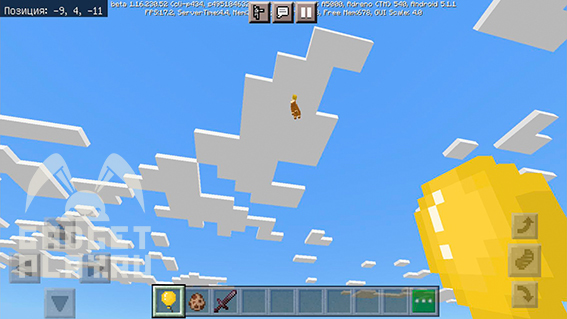
Правда, мобы улетят из-за привязанного к ним шарика.
В шарики можно стрелять из лука или арбалета, и тогда они лопнут.
Светящаяся палочка

Для ее крафта нужно по бокам верстака расположить полиэтилен, сверху пероксид водорода, снизу люминол, а по середине любой краситель.
Использовать эту палочку очень просто — ненадолго удерживаем экран пальцем, и будет анимация встряхивания, после чего палочка будет светиться, однако для освещения местности она не годится, да и время ее действия ограничено.
Укрепленное стекло
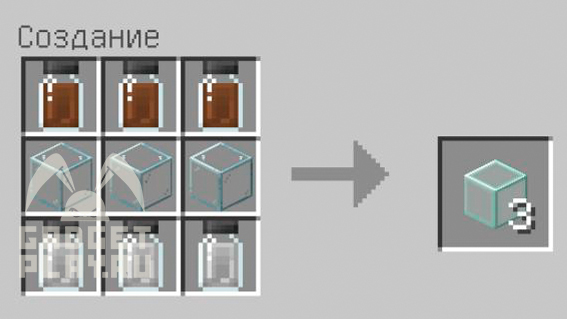
Чтоб сделать укрепленное стекло, понадобится 3 стекла любого цвета (можно и прозрачное), помещаем сверху оксид алюминия, а снизу триоксид бора. Крафт стеклянных панелей аналогичен, только вместо обычного стекла в центре помещаем 3 любых стеклопанели.
Это стекло, по сравнению с обычным, при добыче в выживании может выпасть, а не просто сломаться.
Бенгальский огонь
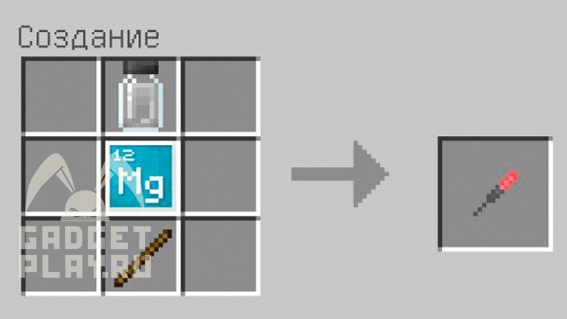
Бенгальский огонь можно получить, соединив один из 5 хлоридов, магний и палку. В зависимости от того, какой хлорид использован (хлорид кальция, калия, ртути, вольфрама или церия), цвет огня будет разным.
Для использования недолго удерживайте палец (либо кликните ПКМ), и после этого бенгальский огонь загорится. Его можно держать в левой руке. Он также, как и светящаяся палочка имеет ограниченное время использования.
Цветной факел
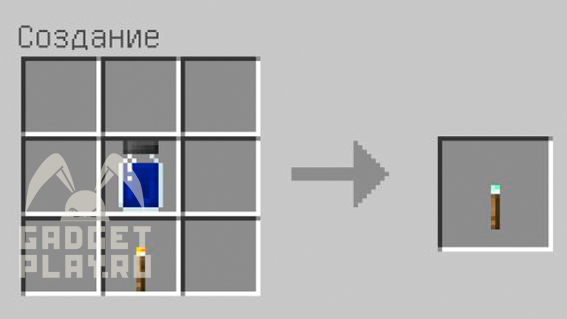
Цветной факел также можно сделать из 5 вышеописанных хлоридов, и точно также, в зависимости от хлорида, у факела будет разный цвет.
Ингредиенты, получаемые из лабораторного стола
И, наконец, рассмотрим ингредиенты, которые можно получить из лабораторного стола. Будьте внимательны при работе с лабораторным столом — одно неправильное объединение и вы получите не то, что нужно, а мусор.
Отбеливатель

Объединяем в лабораторном столе 3 воды и 3 гипохлорита натрия, и получаем отбеливатель.

Он позволяет перекрасить в белый цвет такие вещи, как шерсть, ковер, флаг и кровать.
Тепловой блок

Используя железо (именно химический элемент, а не слиток), воду, уголь и соль, можно создать тепловой блок. Он позволяет растопить снег и лёд. Это единственный блок в игре, который растапливает снег и лёд, не испуская свет.
Ледяная бомба

Делается из 4-х ацетатов натрия. Используется подобно снежку или жемчугу Края. При броске взрывается, и при попадании в воду, вода превращается в небольшой куб.
Суперудобрение
Суперудобрение, по сравнению с костной мукой, позволяет вырастить больше растений при клику по блоку травы, а также суперудобрение выращивает урожай, деревья сразу же, а не через несколько кликов, как костная мука.

Соединяем фосфор и аммиак в лабораторном столе и получаем это удобрение.
А на этом все! спасибо за внимание и приятной игры!
- Свежие записи
- Укладываем художественный паркет самостоятельно
- Как лучше всего защитить стены из газоблока от разрушения в первую зиму после строительства дома
- Арболит, он же — опилкобетон
- Особенности звукоизоляции помещений
- Глина с опилками – самый лучший и дешевый способ утепления бетонных стен дома
- Правообладателям
- Политика конфиденциальности
Источник: ollimpia.ru